题目内容
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图所示。
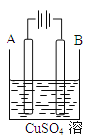
请回答:
①A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
②镀层破损后,镀铜铁和镀锌铁更容易被腐蚀的是 。
(2)下列哪个装置可防止铁棒被腐蚀
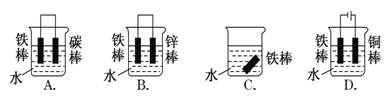
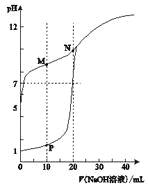
(3)利用右图装置可以模拟铁的电化学防护。
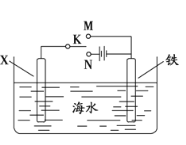
①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:
②若X为锌,开关K置于M处,该电化学防护法称为 ,写出铁电极处的电极反应式:
【答案】(1)①铜(1分)Cu2++2e-=Cu(2分)②镀铜铁(1分)(2)BD(2分)
(3)①N(1分)2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑(2分)
2OH-+H2↑+Cl2↑(2分)
②牺牲阳极的阴极保护法(1分)O2+2H2O+4e—=4OH—(2分)
【解析】
试题分析:(1)①电镀时待镀金属作阴极,镀层金属作阳极。A电极与电源的正极相连,作阳极,对应的金属是铜,B电极是铁,溶液中的铜离子放电,电极反应式是Cu2++2e-=Cu。
②金属性是Zn>Fe>Cu,所以镀层破损后,镀铜铁和镀锌铁更容易被腐蚀的是镀铜铁。
(2)A、铁、石墨和水构成原电池,铁是负极,被腐蚀,A错误;B、锌的金属性强于铁,铁是正极,被保护,B正确;C、铁棒放在水中容易发生电化学腐蚀,C错误;D、铁和电源的负极相连,作阴极被保护,D正确,答案选BD。
(3)①若X为碳棒,为减缓铁的腐蚀,开关K应置于N处构成电解池,铁是阴极,被保护;假设海水中只有NaCl溶质,此时总离子反应方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
②若X为锌,开关K置于M处构成原电池,铁是正极,被保护,该电化学防护法称为牺牲阳极的阴极保护法,铁电极处氧气得到电子,电极反应式为O2+2H2O+4e—=4OH—。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案