题目内容
【题目】在容积一定的密闭容器中,反应A2(g)+B2(g)![]() xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
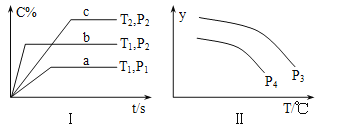
A. P3<P4,y为A2转化率
B. P3<P4,y为A2浓度
C. P3>P4,y为混合气密度
D. P3>P4,y为C的体积分数
【答案】D
【解析】由图Ⅰ,a、b曲线温度相等,则先达到平衡的b曲线对应的压强p2更大,曲线b的C物质的含量比压强小的P1大,所以反应后气体系数更小,即1+1>x,x只能等于1。b、c曲线压强相等,则先达到平衡的b曲线对应的温度T1更高,曲线b的C物质含量比温度低的T2的小,说明升高温度,平衡逆向移动,正反应为放热反应。
对于图Ⅱ,等温时p3的y值更大。如果P3<P4,压强由P3变化到P4,压强增大时平衡向气体体积减小的正反应方向移动,反应物A2的转化率增大,因此,当y表示A2的转化率时,温度相同时压强为P4的曲线应当位于压强为P3的曲线上方,所以A错误;而温度升高时,上述放热反应平衡向逆反应方向移动,A2的浓度增大,因此,当y表示A2浓度时,曲线的走向应当是逐渐增大,所以B错误。C、由于容器体积一定、混合气体总质量不变,所以混合气体的密度始终不变,当y表示混合气体密度时,每条图线均为平行与横坐标的直线,因此C错误。D、P3>P4,压强由P3变化到P4,压强减小时平衡向逆反应方向移动,产物C不断消耗,当温度相同时,压强更小的P4对应的产物C体积分数更小,曲线位于下方,图Ⅱ符合;而温度升高时,平衡向逆反应方向移动,产物C不断消耗,y表示C的体积分数时,曲线走向逐渐向下,图Ⅱ也符合,所以D正确。正确答案D。

练习册系列答案
相关题目