题目内容
【题目】用0.1 molL-1的NaOH溶液分别滴定体积均为20mL、浓度均为0.1 molL-1的HC1溶液和HX溶液,溶液的pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
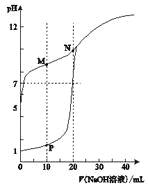
A. M点对应溶液中:c(HX)<c(X-)
B. HX的电离平衡常数Ka约为1×10-5
C. P点对应溶液中 c(Cl-) ="0.05" mol L-1
D. N点对应溶液pH>7的原因是X-+ H2O![]() HX+OH-
HX+OH-
【答案】D
【解析】试题分析:V(NaOH)=10.00mL时,M点对应溶液中溶质等物质的量的NaX、HX,溶液呈碱性,说明X-水解程度大于HX 电离程度,所以c(HX)>c(X-),故A错误;0.1 molL-1HX溶液PH=5,HX的电离平衡常数Ka约为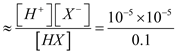 =1×10-9,故B错误;V(NaOH)=10.00mL时,P点对应溶液中c(Cl-)=
=1×10-9,故B错误;V(NaOH)=10.00mL时,P点对应溶液中c(Cl-)=![]() ,故C错误;V(NaOH)=20.00mL时, N点对应溶液中溶质是NaX,pH>7的原因是X-+ H2O
,故C错误;V(NaOH)=20.00mL时, N点对应溶液中溶质是NaX,pH>7的原因是X-+ H2O![]() HX+OH-,故D正确。
HX+OH-,故D正确。

练习册系列答案
相关题目