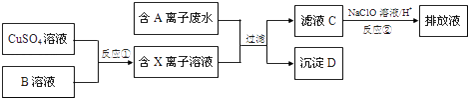
��Ŀ����
����Ŀ�������£��������pH��Ϊ3��HA��HB��Һ�ֱ��ˮϡ�ͣ���ҺpHֵ�ı仯����ͼ��ʾ������˵����ȷ���ǣ� ��
A.��HB��Һ�еμ�NaOH��Һ�Ĺ����У�ˮ�ĵ���̶�һֱ����
B.��pHΪ11��ij����pHΪ3��HB��Һ�������Ϻ���Һ�������Լ���
C.��ˮ��HA��Һ��Ϻ����Һ�п��ܴ��ڣ�c(NH4�� )>c(A��)>c(H��)>c(OH��)
D.��ȫ�к͵������pH��HA��HB����Һʱ������ͬŨ��NaOH��Һ�������HA<HB
���𰸡�D
��������A����HB��Һ�еμ�NaOH��Һ�Ĺ����У���������ɵ�NaBˮ�⣬�ٽ�ˮ�ĵ��룬����NaOH����������NaOH������ˮ�ĵ��룬��A���������⣻
B�������£�pH֮�͵���14����ͼ�������ϣ����Һ��������ǡ�˭����˭�ԣ�˫ǿ�����ԡ�������ȳ�Ũ�ȼ�ĵ���̶ȱ�HB��С������Һ�Լ��ԣ���B���������⣻
C����ˮ��HA��Һ��Ϻ����Һ�п϶����ڵĵ���غ�ʽ��c(NH4�� )+c(H��)=c(A-)+c(OH��)������c(NH4�� )>c(A-)>c(H��)>c(OH��)�϶�����������C���������⣻
D����HB��HA����pH��ȵ�HA��HB��δ�����HB�����ʵ�����HA�����ʵ���������ȫ�к͵������pH��HA��HB����Һʱ������ͬŨ��NaOH��Һ�������HA<HB����D�������⣻
��Ϊ��D������pH��ͬ��һԪ����ˮϡ����ͬ�ı����������pH�仯�̶�С����ͼʾ��֪HB�����Ա�HA�����ݴ˽�ɡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�