题目内容
I2在KI溶液中存在下列平衡: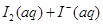

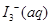 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,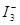 的物质的量浓度c(
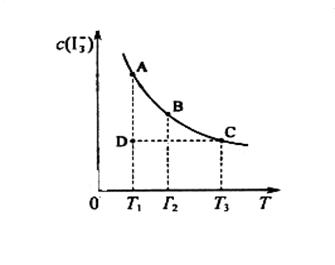
的物质的量浓度c(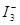 )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
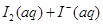

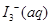 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,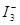 的物质的量浓度c(
的物质的量浓度c(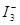 )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.反应 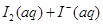  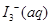 △H>0 △H>0 |
B.若温度为 ,反应的平衡常数分别为 ,反应的平衡常数分别为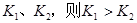 |
C.若反应进行到状态D时, |
| D.状态A与状态B相比,状态A的c(I2)大 |
BC
试题分析:由图像可知温度升高,c(I3-)减小,说明
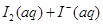

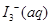 正反应是放热反应,A错误;正反应是放热反应,温度升高,平衡向左移动,平衡常数减小,B正确;T1时,D点不是平衡状态,D点建立平衡的过程中,c(I3-)增大,反应向右进行,
正反应是放热反应,A错误;正反应是放热反应,温度升高,平衡向左移动,平衡常数减小,B正确;T1时,D点不是平衡状态,D点建立平衡的过程中,c(I3-)增大,反应向右进行, ,C正确;由A点到B点,温度升高,平衡向左移动,A2浓度增大,D错误。
,C正确;由A点到B点,温度升高,平衡向左移动,A2浓度增大,D错误。点评:首先看清图像中各坐标轴表示的意义,然后分析曲线的变化趋势,结合勒沙特列原理分析得出正确结论。

练习册系列答案
相关题目
 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是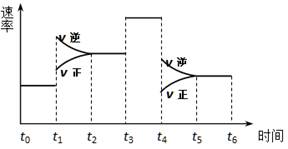
 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是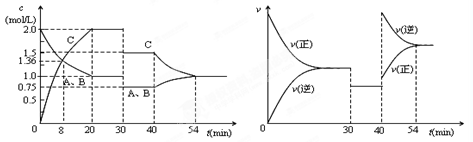
 W(s)+3 H2O(g)
W(s)+3 H2O(g)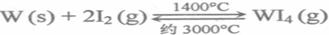
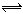 CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则
CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则 (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
(CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
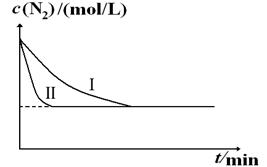
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。