题目内容
25℃时,有关弱酸的电离平衡常数如下,则下列有关说法不正确的是( )
A.25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则
c(Na+)-c(CH3COO-)=9.9×10-7mol/L
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等.
C.25℃时,0.1mol/L的各溶液的pH关系pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
c(Na+)-c(CH3COO-)=9.9×10-7mol/L
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等.
C.25℃时,0.1mol/L的各溶液的pH关系pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C
试题分析:根据25℃时,若同浓度的醋酸和氢氧化钠等体积混合后生成醋酸钠,强碱弱酸盐显碱性。若溶液pH=8,则由c(OH-)×c(H+)="Kw" 和 PH=—lgC(H+)得
c(OH-)-c(H+)=9.9×10-7mol/L 由电荷守恒得c(Na+) + c(H+) =c(OH_)+c(CH3COO-)
c(Na+)-c(CH3COO-)=9.9×10-7mol/L ,所以A正确;25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等,正确,因为 PH=—lgC(H+) ;NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)这是电荷守恒,所以D正确;
弱酸的电离平衡常数可以看到:醋酸最强,碳酸次之,接下来是氢氰酸,碳酸氢根最弱,所以他们对应的钠盐,PH 的大小关系是pH(Na2CO3)>(NaCN)>pH(CH3COONa),所以C错误。故选C。
点评:这是教学的重难点,也是考试的重点。弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量为幂的乘积的比值,即溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数。这个常数叫电离平衡常数,简称电离常数。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
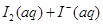

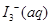 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,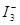 的物质的量浓度c(
的物质的量浓度c(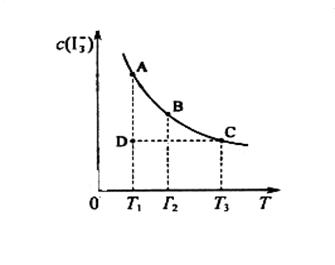
 ,反应的平衡常数分别为
,反应的平衡常数分别为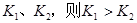

 PCl5(g),达平衡时PCl5为0.4mol,如果此时移走1.0molPCl3和0.5molCl2,在 相同温度下再次达到平衡时,PCl5的物质的量为 ( )
PCl5(g),达平衡时PCl5为0.4mol,如果此时移走1.0molPCl3和0.5molCl2,在 相同温度下再次达到平衡时,PCl5的物质的量为 ( ) 4NO(g)+6H2O(g) ΔH<0若此反应起始的物质的量相同,则下列关系图正确的是
4NO(g)+6H2O(g) ΔH<0若此反应起始的物质的量相同,则下列关系图正确的是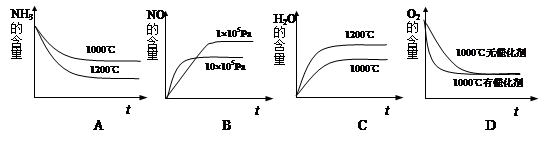
 C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题: 2SO3,下列判断正确的是
2SO3,下列判断正确的是  CO(g)+H2(g) , 试分析和回答下列问题:
CO(g)+H2(g) , 试分析和回答下列问题: 的取值范围是 。
的取值范围是 。 2NH3(g) △H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
2NH3(g) △H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是