题目内容
在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:
CO(g) + H2O(g)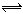 CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则
CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则
该条件下该反应的平衡常数为( )
CO(g) + H2O(g)
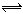 CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则
CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为( )
| A.0.25 | B.0.17 | C.0.44 | D.1.0 |
B
试题分析:设容器体积为VL,平衡时CO、H2O、CO2、H2物质的量浓度分别为0.6/Vmol/L、1.6/Vmol/L、0.4/Vmol/L、0.4/Vmol/L,所以平衡常数K=c(CO2)·c(H2)/c(CO)·c(H2O)=1/6。
点评:代入化学平衡常数的数值是平衡时各物质的浓度,而非物质的量。固体和纯液体不写入平衡常数表达式。

练习册系列答案
相关题目
 Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为 Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将( )
Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将( ) CO2 + H2,在830K温度下达到平衡。
CO2 + H2,在830K温度下达到平衡。
 N2O4平衡体系 ,向生成N2O4的方向移动
N2O4平衡体系 ,向生成N2O4的方向移动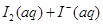

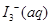 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,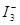 的物质的量浓度c(
的物质的量浓度c(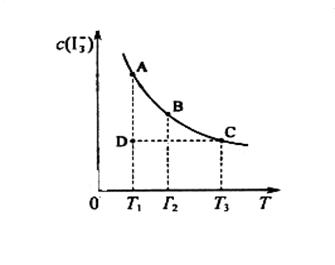
 ,反应的平衡常数分别为
,反应的平衡常数分别为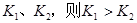

 C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是 C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题: