题目内容
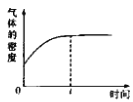
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。下列说法正确的是( )
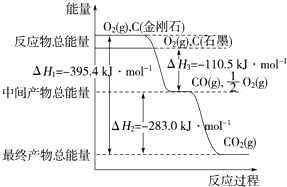
A.等质量的金刚石和石墨完全燃烧,石墨放出的热量更多
B.在通常状况下,金刚石和石墨相比,金刚石更稳定
C.表示石墨燃烧热的热化学方程式为C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
D.36 g石墨转化成金刚石,放出的热量为5.7 kJ
【答案】C
【解析】
由图可知:1molO2+1molC(金刚石)的能量比1molCO2的能量高395.4KJ,即1molO2和1molC(金刚石)完全反应生成1molCO2放出395.4KJ的能量;1molO2+1molC(石墨)的能量比1molCO+![]() mol O2的能量高110.5KJ,即
mol O2的能量高110.5KJ,即![]() molO2和1molC(石墨)反应生成1molCO放出110.5KJ的能量;1molCO+
molO2和1molC(石墨)反应生成1molCO放出110.5KJ的能量;1molCO+![]() mol O2的能量比1molCO2的能量高283.0KJ,即1molCO和
mol O2的能量比1molCO2的能量高283.0KJ,即1molCO和![]() mol O2完全反应生成1molCO2放出283.0KJ的能量。
mol O2完全反应生成1molCO2放出283.0KJ的能量。
A. 根据图像,金刚石与氧气的总能量大于石墨与氧气的总能量,生成的产物的能量相同,所以金刚石完全燃烧放出的能量多,故A错误;
B. 因为金刚石与氧气的总能量大于石墨与氧气的总能量,而氧气等量,所以金刚石的能量大于石墨的能量,能量越低越稳定,所以石墨稳定,故B错误;
C. 从图可知,![]() molO2和1molC(石墨)反应生成1molCO放出110.5KJ的能量,1molCO和
molO2和1molC(石墨)反应生成1molCO放出110.5KJ的能量,1molCO和![]() mol O2完全反应生成1molCO2放出283.0KJ的能量,则1molO2和1molC(石墨)反应生成1mol CO2放出393.5 KJ的能量。根据燃烧热的定义,表示石墨燃烧热的热化学方程式应写成:C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,故C正确;
mol O2完全反应生成1molCO2放出283.0KJ的能量,则1molO2和1molC(石墨)反应生成1mol CO2放出393.5 KJ的能量。根据燃烧热的定义,表示石墨燃烧热的热化学方程式应写成:C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,故C正确;
D. 由图可知,金刚石能量比石墨高,所以石墨转化为金刚石应吸收热量, 故D错误;
答案选C。

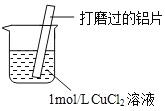
【题目】探究Al与CuCl2溶液反应,实验如下:下列说法不正确的是( )
实验 | 现象 |
| a.Al片表面附着蓬松的红色固体 b.产生无色气体,起始速率较慢,之后加快 c.反应放热 d.烧杯底部产生少量不溶于稀盐酸的白色沉淀 e.溶液pH降低 |
A.无色气体是H2
B.实验中影响化学反应速率的因素只有两个,分别是浓度和温度
C.白色沉淀的出现与氧化还原反应有关
D.将铝片改为铝粉会加快化学反应速率
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
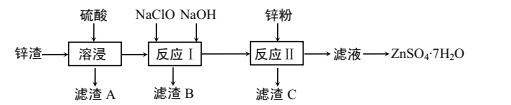
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O