题目内容
据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是
| A.锌为正极,空气进入负极反应 |
| B.负极反应为Zn+2OH--2e-=ZnO+H2O |
| C.正极发生氧化反应 |
| D.电解液肯定是强酸 |
B
解析试题分析:,在原电池中化合价升高的做负极,从总反应式中,我们知道锌化合价升高,所以锌做负极。故A选项是错误的C选项正极发生的是还原反应。所以C选项是错误的。D选项,由于氧化锌会与强酸反应,所以电解质溶液一定不是强酸,所以D选项是错误的。B选项,由于氧化锌与酸性溶液反应,所以该原电池只能在碱性条件下进行。负极失去电子,被氧化,发生氧化反应。因此B选项是正确的
考点:考查原电池的相关知识点。

练习册系列答案
相关题目
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是 
| A.正极的电极方程式为:O2+2H2O+4e-===4OH- |
| B.将石墨电极改成Mg电极,难以观察到铁锈生成 |
| C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 |
| D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为


下列叙述不正确的是
A.充电时阳极反应为: |
B.放电时负极反应为: |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
下列关于下图所示原电池装置的叙述中,正确的是( ) 
| A.铜片作负极,质量逐渐减小 | B.溶液的pH逐渐减小 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)
构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:
4LiCl+S+SO2  4Li+2SOCl2。下列说法正确的是( )
4Li+2SOCl2。下列说法正确的是( )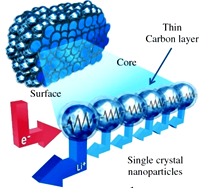
| A.电池的电解液可为LiCl水溶液 |
| B.该电池放电时,负极发生还原反应 |
| C.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
| D.放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
按下图所示装置进行有关实验,则下列叙述正确的是
| A.甲装置用作原电池时,锌为正极 |
| B.甲装置用作原电池时,银棒上发生:Ag+ +e-= Ag |
| C.乙装置用作铜片镀镍时,镍作阴极 |
| D.实现铜片表面镀镍时,可将甲中锌棒与乙中铜片相连,甲中银棒与乙中镍片相连 |
下列关于原电池的叙述中,正确的是( )
| A.把电能转化为化学能,使溶液发生氧化还原反应 |
| B.电子从活泼金属流向不活泼金属,不活泼金属为负极 |
| C.外电路中电子从负极流向正极 |
| D.正极发生氧化反应 |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-==2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置 |
