题目内容
5.分析图所示的四个原电池装置,结论正确的是( )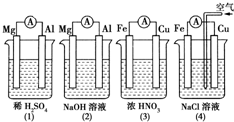
| A. | (1)(2)中Mg作负极,(3)(4)中Fe作负极 | |
| B. | (2)中Mg作正极,电极反应式为:6H2O+6e-═6OH-+3H2↑ | |
| C. | (3)中Fe作电池负极,电极反应式为:Fe-3 e-═Fe3+ | |
| D. | (4)中Cu作正极,电极反应式为:2H++2e-═H2↑ |
分析 A、根据氧化还原反应,失电子的极是负极;
B、原电池的正极发生得电子的还原反应;
C、铜作负极发生氧化反应;
D、铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀.
解答 解:A、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,③中金属铁在常温下遇浓硝酸钝化,失电子的是金属铜,为负极,故A错误;
B、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑,故B正确;
C、③中金属铁在常温下遇浓硝酸钝化,失电子的是金属铜为负极发生氧化反应,所以铜失电子生成铜离子,即电极反应式为Cu-2e-═Cu2+,故C错误;
D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误.
故选B.
点评 本题考查学生原电池的工作原理知识,可以根据所学内容来回答,难度不大.

练习册系列答案
相关题目
13. 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
①分子式为C10H9O3
②1mol该有机物能与溴水中3mol溴发生取代反应
③该物质含有3种官能团
④能使酸性KMnO4溶液褪色.
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②1mol该有机物能与溴水中3mol溴发生取代反应
③该物质含有3种官能团
④能使酸性KMnO4溶液褪色.
| A. | ③④ | B. | ①④ | C. | ②③④ | D. | ①②③④ |
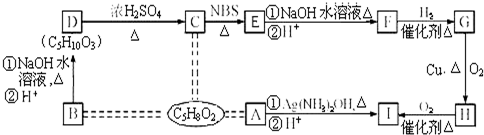
10. 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 | |
| B. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| C. | 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |
17.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.
(4)有两种化合物均由①、④、⑤、⑧四种元素形成,两者之间可以相互发生化学反应,其离子反应方程式为:HSO3-+H+=H2O+SO2↑.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.(4)有两种化合物均由①、④、⑤、⑧四种元素形成,两者之间可以相互发生化学反应,其离子反应方程式为:HSO3-+H+=H2O+SO2↑.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
14.观察分析,符合图中变化的化学反应为( )


| A. | A2+3B2═2AB3 | B. | 2AB2+B2═2AB3 | C. | 2A2B+5B2=4AB3 | D. | 2AB2+B2=2AB3 |
15.对于Fe+H2SO4=FeSO4+H2↑反应,下列条件能加快化学反应速率的是( )
| A. | 升高温度 | B. | 加水 | C. | 改用98%的浓硫酸 | D. | 加入NaHCO3固体 |
 .
. 的系统命名法的名称为2,2,5,5-四甲基庚烷.
的系统命名法的名称为2,2,5,5-四甲基庚烷.
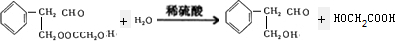
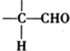 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$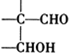 -CHO+
-CHO+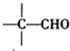 +NaOH(浓)→
+NaOH(浓)→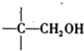 +
+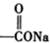
 ③
③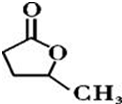 、
、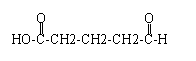 .
.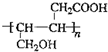 .
.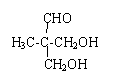 .
.