题目内容
15.对于Fe+H2SO4=FeSO4+H2↑反应,下列条件能加快化学反应速率的是( )| A. | 升高温度 | B. | 加水 | C. | 改用98%的浓硫酸 | D. | 加入NaHCO3固体 |
分析 影响化学反应速率的因素有温度、浓度、压强、催化剂和固体的接触面积,浓硫酸能够使Fe钝化,据此分析.
解答 解:A、升温化学反应速率加快,故A正确;
B、加水稀释,硫酸浓度降低,反应速率减慢,故B错误;
C、Fe在浓硫酸中钝化,不能生成氢气,故C错误;
D、加入NaHCO3固体,能够反应氢离子,氢离子浓度降低,反应速率减慢,故D错误;
故选A.
点评 本题考查了影响化学反应速率的因素,主要浓硫酸能够使Fe钝化,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
5.分析图所示的四个原电池装置,结论正确的是( )
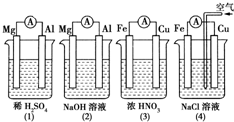

| A. | (1)(2)中Mg作负极,(3)(4)中Fe作负极 | |
| B. | (2)中Mg作正极,电极反应式为:6H2O+6e-═6OH-+3H2↑ | |
| C. | (3)中Fe作电池负极,电极反应式为:Fe-3 e-═Fe3+ | |
| D. | (4)中Cu作正极,电极反应式为:2H++2e-═H2↑ |
6.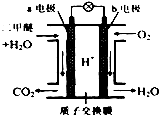 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | O2在b电极上得电子,电极反应式:O2+4e-+2H2O═4OH- |
3.热激活电池可用作火箭、导弹的工作电源.一种热激活电池中作为电解质的固体LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,OH-向负极移动 | |
| C. | 放电时,电流由钙电极流向硫酸铅电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
20.下列解释事实的方程式表达不正确的是( )
| A. | 氨水呈碱性:NH3•H2O=NH4++OH- | |
| B. | 碳酸氢钠治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | 久置的浓硝酸呈黄色:4HNO3=4NO2↑+O2↑+2H2O | |
| D. | 久置碳酸氢铵有刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O |
17.硫在空气中燃烧生成气体A.把A溶于水得溶液B.向B中滴加溴水,溴水褪色,B变成C.在C里加Na2S产生气体D.把D通入B溶液得浅黄色沉淀E.按A、B、C、D、E顺序排列的是( )
| A. | SO2、H2SO4、H2SO3、H2S、S | B. | SO2、H2SO3、H2SO4、H2S、S | ||
| C. | SO2、H2SO3、H2SO4、SO3、S | D. | SO2、H2SO3、H2SO4、SO2、S |

 ;
;