题目内容
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下:

Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入3 mL浓硫酸、12.2 g苯甲酸、20 mL甲醇(密度约为0.79 g/cm3)。
(1)液体混合时,正确的加入顺序是 。
(2)为防止圆底烧瓶中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)在该反应中反应物甲醇应过量,其理由是 。
Ⅱ.粗产品的精制
(4)现拟用下列流程精制苯甲酸甲酯,请根据流程图填入恰当操作方法的名称:操作1为 ,操作2为 。

(5)苯甲酸甲酯的产率为 。
(6)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,某同学做了如下检验。

【答案】(1)先加入12.2 g苯甲酸和20 mL甲醇,再小心加入3 mL浓硫酸
(2)加入几粒沸石或碎瓷片
(3)该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,故可增加甲醇的量,以提高苯甲酸的转化率
(4)分液 蒸馏
(5)65%
(6)如表
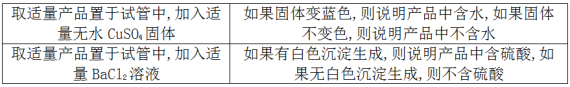
【解析】本题主要考查常见物质的制备、检验、分离提纯,意在考查考生的基本实验技能。
(1)当浓硫酸与其他溶液混合时,应先加密度较小的溶液,再缓慢加入浓硫酸,并不断搅拌,防止暴沸而使溶液溅出。(2)加热时为防止液体暴沸,应加入沸石或碎瓷片。(3)制取苯甲酸甲酯的反应为可逆反应,通常采用提高价廉物质的浓度使平衡右移,从而提高贵重原料的转化率,提高经济效益。(4)有机物大部分不溶于水且与水分层,故可以采用分液的方法加以分离;有机混合物常利用沸点的差异(相差20 ℃以上)通过蒸馏进行分离。
(5)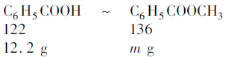
计算可得m=13.6,所以苯甲酸甲酯的产率=×100%=×100%=65%。

练习册系列答案
相关题目