题目内容
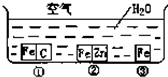 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,如下图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,如下图所示,铁处于①、②、③三种不同的环境中.请回答:(1)金属腐蚀主要分为
(2)铁被腐蚀的速率由快到慢的顺序是
(3)②中正极的电极反应式为
③中负极的电极反应式为
分析:(1)金属和化学物质直接反应的是化学腐蚀,金属和电解质溶液构成原电池的是电化学腐蚀;
(2)在原电池中作负极的金属加快被腐蚀,在原电池中作正极的金属被保护而减缓腐蚀;
(3)①中构成原电池,铁作负极,碳作正极,正极上氧气得电子发生还原反应,②中也构成原电池,锌作负极,铁作正极,负极上金属失电子发生氧化反应.
(2)在原电池中作负极的金属加快被腐蚀,在原电池中作正极的金属被保护而减缓腐蚀;
(3)①中构成原电池,铁作负极,碳作正极,正极上氧气得电子发生还原反应,②中也构成原电池,锌作负极,铁作正极,负极上金属失电子发生氧化反应.
解答:解:(1)金属的腐蚀有:与化学物质直接反应的腐蚀和构成原电池而产生电流的腐蚀,所以分为化学腐蚀和电化学腐蚀,故答案为:化学;电化学;
(2)①中铁作原电池负极而能加快铁的腐蚀,②中铁作原电池正极而被保护,所以铁被腐蚀的速率由快到慢的顺序是①>③>②,
故答案为:①>③>②;
(3)①中碳作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,②中锌作负极,负极上金属失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,③中铁为负极,电极反应式为Fe-2e-=Fe2+,
故答案为:2H2O+O2+4e-=4OH-;Zn-2e-=Zn2+;Fe-2e-=Fe2+.
(2)①中铁作原电池负极而能加快铁的腐蚀,②中铁作原电池正极而被保护,所以铁被腐蚀的速率由快到慢的顺序是①>③>②,
故答案为:①>③>②;
(3)①中碳作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,②中锌作负极,负极上金属失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,③中铁为负极,电极反应式为Fe-2e-=Fe2+,
故答案为:2H2O+O2+4e-=4OH-;Zn-2e-=Zn2+;Fe-2e-=Fe2+.
点评:本题考查了金属的腐蚀与防护,根据原电池原理来分析解答即可,难度不大,注意金属的腐蚀与防护是高考的热点,应重点掌握.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁锈蚀的影响因素,某同学做了如下探究实验:
回答下列问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) ;在电化学腐蚀中,负极反应是 ;正极反应是 ;
(2)由该实验可知,可以影响铁锈蚀速率的因素是 ;
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法).
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
(1)上述实验中发生了电化学腐蚀的是(填实验序号)
(2)由该实验可知,可以影响铁锈蚀速率的因素是
(3)为防止铁的锈蚀,工业上普遍采用的方法是
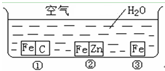 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答: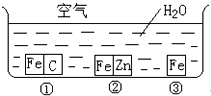 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: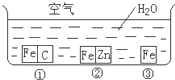 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: