题目内容
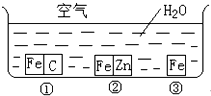 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:(1)金属腐蚀主要分为
化学
化学
腐蚀和电化学
电化学
腐蚀两种.(2)铁被腐蚀的速率由快到慢的顺序是
①③②
①③②
(填序号).(3)下列对金属制品采取的防护方法不正确的是
C
C
(填序号).A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(4)已知铁钉样品质量为4.00g,经实验测得未锈蚀铁的质量分数为70%.则未锈蚀铁与足量稀硫酸反应生成氢气的体积为
1.12L
1.12L
(标准状况).分析:(1)金属的腐蚀主要分为化学腐蚀和电化学腐蚀;
(2)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护;
(3)A.外面包上一层塑料层可减少与空气的接触;
B.镀上一层金属铬可以隔绝空气;
C.原电池能加快化学反应速率.
(4)根据铁与氢气之间的关系式计算氢气的体积.
(2)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护;
(3)A.外面包上一层塑料层可减少与空气的接触;
B.镀上一层金属铬可以隔绝空气;
C.原电池能加快化学反应速率.
(4)根据铁与氢气之间的关系式计算氢气的体积.
解答:解:(1)金属的腐蚀主要分为化学腐蚀和电化学腐蚀,故答案为:化学;电化学;
(2)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护,则该金属被腐蚀的速率由快到慢的顺序是①③②,
故答案为:①③②;
(3)A.外面包上一层塑料层可减少与空气中氧气的接触,故A正确;
B.镀上一层金属铬可以隔绝空气,使金属不受腐蚀,故B正确;
C.原电池能加快化学反应速率,铁铜海水构成原电池,加快铁的腐蚀,故C错误;
故选C;
(4)设生成氢气的体积是V,
Fe+H2SO4=FeSO4+H2↑
56g 22.4L
4.00g×70% V
V=
=1.12L,
答:生成氢气的体积是1.12L.
(2)金属腐蚀时,原电池腐蚀比化学腐蚀快,当铁为原电池负极时,易被氧化而腐蚀,当为原电池正极时,得到保护,则该金属被腐蚀的速率由快到慢的顺序是①③②,
故答案为:①③②;
(3)A.外面包上一层塑料层可减少与空气中氧气的接触,故A正确;
B.镀上一层金属铬可以隔绝空气,使金属不受腐蚀,故B正确;
C.原电池能加快化学反应速率,铁铜海水构成原电池,加快铁的腐蚀,故C错误;
故选C;
(4)设生成氢气的体积是V,
Fe+H2SO4=FeSO4+H2↑
56g 22.4L
4.00g×70% V
V=
| 4.00g×70%×22.4L |
| 56g |
答:生成氢气的体积是1.12L.
点评:本题考查了金属的腐蚀与防护、氧化还原反应的有关计算等知识点,难度不大,根据金属腐蚀特点选取相应的保护方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁锈蚀的影响因素,某同学做了如下探究实验:
回答下列问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) ;在电化学腐蚀中,负极反应是 ;正极反应是 ;
(2)由该实验可知,可以影响铁锈蚀速率的因素是 ;
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法).
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
(1)上述实验中发生了电化学腐蚀的是(填实验序号)
(2)由该实验可知,可以影响铁锈蚀速率的因素是
(3)为防止铁的锈蚀,工业上普遍采用的方法是
 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答: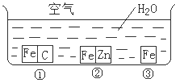 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: