题目内容
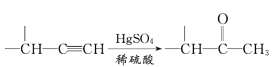
【题目】已知H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3![]() H++HSO3-,HSO3-
H++HSO3-,HSO3-![]() H++SO32-;H2CO3
H++SO32-;H2CO3![]() H++HCO3-;HCO3-
H++HCO3-;HCO3-![]() H++CO32-;电离平衡常数分别为K1、K′1、K2、K′2,已知K1>K′1≈K2>K′2,则溶液中不可以大量共存的离子组是 ( )
H++CO32-;电离平衡常数分别为K1、K′1、K2、K′2,已知K1>K′1≈K2>K′2,则溶液中不可以大量共存的离子组是 ( )
A. SO32-、HCO3-B. HSO3-、CO32-C. SO32-、CO32-D. HSO3-、HCO3-
【答案】B
【解析】
电离平衡常数越大,说明物质的酸性越强,根据强酸能制取弱酸判断。
A、根据电离平衡常数大小关系,HCO3-的酸性比HSO3-弱,所以SO32-、HCO3-能够大量共存,故A不符合题意;
B、HSO3-的电离平衡常数大于HCO3-的电离平衡常数,HSO3-和CO32-反应生成HCO3-和SO32-,不能大量共存,故B符合题意;
C、SO32-、CO32-均只能发生水解,之间不反应,两者能够大量共存,故C不符合题意;
D、因为HSO3-的电离平衡常数和H2CO3的电离平衡常数相当,因此HSO3-和HCO3-不发生反应,能够大量共存,故D不符合题意;
本题答案选B。

练习册系列答案
相关题目