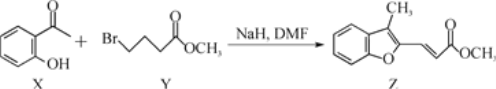题目内容
【题目】(选修3:物质结构与性质)
工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_______。和O同一周期且元素的第一电离能比O大的有_____(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为______________。
(3)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
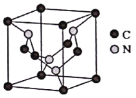
①该晶体的化学式为______;其硬度超过金刚石的原因是___________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为__________________(用含d、r1、r2、NA的代数式表示)。
【答案】ls22s22p63s23p63d24s2或[Ar]3d24s2 N、F、Ne N H2<CO<CH3CH2OH<H2O 7:1 C3N4 该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大 ![]()
【解析】
(1)Ti是22号元素,处于第四周期第IVB族,结合能量最低原理书写核外电子排布式;同周期稀有气体第一电离能最大,同周期主族元素随原子序数增大第一电离能呈增大趋势,当IIA族、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素的;O原子有2个未成对电子,和O同一周期且基态原子核外未成对电子数比O多,原子的未成对电子数为3,处于VA族;
(2)H2O分子中O原子形成2个OH键,还有2对孤电子对;CH3CH2OH分子中亚甲基(CH2)上的C原子形成4个σ键、没有孤电子对,杂化轨道数目为4;
(3)氢气为非极性分子,其它三种均为极性分子,分子之间形成氢键的物质,沸点相对更高,而分子之间形成氢键越多,沸点越高。分子极性越大、相对分子质量越大,范德华力越强,沸点越高;
(4)CO(NH2)2分子中含有1个C=O键、2个CN键、4个NH键,单键为σ键,双键含有1个σ键、1个π键;
(5)①原子半径越小,键长越短,键能越大,晶体硬度越大;②均摊法计算晶胞中
C、N原子数目,计算晶胞中原子总体积,结合密度计算晶胞体积,晶胞的空间利用率=![]() ×100%。
×100%。
(1)![]() 是22号元素,处于第四周期第IVB族,核外电子排布式为:
是22号元素,处于第四周期第IVB族,核外电子排布式为:![]() ,同周期稀有气体第一电离能最大,同周期主族元素随原子序数增大第一电离能呈增大趋势,当IIA族、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素的,第一电离能大于氧元素有
,同周期稀有气体第一电离能最大,同周期主族元素随原子序数增大第一电离能呈增大趋势,当IIA族、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素的,第一电离能大于氧元素有![]() ;
;![]() 原子有2个未成对电子,和
原子有2个未成对电子,和![]() 同一周期且基态原子核外未成对电子数比
同一周期且基态原子核外未成对电子数比![]() 多,原子的未成对电子数为3,处于VA族,该元素为
多,原子的未成对电子数为3,处于VA族,该元素为![]() 元素,
元素,
故答案为:![]() ;
;![]() ;
;![]() ;
;
(2)![]() 为非极性分子,
为非极性分子,![]() 为极性分子且
为极性分子且![]() 的相对分子质量比
的相对分子质量比![]() 的大,因此
的大,因此![]() 的范德华力比
的范德华力比的大;
![]() 与
与![]() 均为分子间存在氢键的极性分子,但水分子形成的氢键数目比乙醇分子多,故沸点:
均为分子间存在氢键的极性分子,但水分子形成的氢键数目比乙醇分子多,故沸点:![]() ,
,
故答案为:![]() ;
;
(3)![]() 分子中含有1个
分子中含有1个![]() 键、2个
键、2个![]() 键、4个
键、4个![]() 键,单键为σ键,双键含有1个σ键、1个π键,分子中有7个σ键、1个π键,
键,单键为σ键,双键含有1个σ键、1个π键,分子中有7个σ键、1个π键,![]() 分子中含有的σ键与π键的数目之比为7:1,
分子中含有的σ键与π键的数目之比为7:1,
故答案为:7:1;
(4)①根据均摊原则,晶胞中![]() 原子数目为:
原子数目为:![]() ,
,![]() 原子数为4,故该晶体的化学式为
原子数为4,故该晶体的化学式为![]() ,
,![]() 原子半径小于碳原子半径,故晶体中的
原子半径小于碳原子半径,故晶体中的![]() 键的键长比金刚石中的
键的键长比金刚石中的![]() 键的键长短,
键的键长短,![]() 键的键能大,故硬度较金刚石大;
键的键能大,故硬度较金刚石大;
故答案为:![]() ;该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大;
;该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大;
②晶胞中![]() 原子数3、
原子数3、![]() 原子数4,晶胞中原子总体积
原子数4,晶胞中原子总体积![]() ,晶胞质量
,晶胞质量![]() ,晶胞体积
,晶胞体积![]() ,晶胞的空间利用率为原子总体积除以晶胞体积,
,晶胞的空间利用率为原子总体积除以晶胞体积,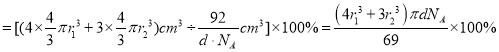 ,
,
故答案为:![]()

 轻松暑假总复习系列答案
轻松暑假总复习系列答案