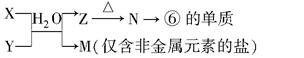题目内容
某化合物M(式量为80)俗称黑肥宝,它由原子序数不大于20的X、Y、Z三种元素组成,X、Y、Z的原子序数依次增大,其关系为Z=X+2Y。X、Y是同周期相邻的两种元素。M微溶于水,在常温下与水作用发生缓慢水解,最终产物为一种白色沉淀A与气体B,该气体能使湿润的红色石蕊试纸变蓝,A在高温条件下可分解产生一种有温室效应的气体。(注:以下回答若涉及到具体物质均用相应的化学式或元素符号表示)
(1)化合物M的化学式为 ;Z的原子结构示意图为 。
(2)写出下列反应的化学方程式。A在高温下分解: ; M与水反应生成A和B: 。
(3)Z的氢化物可作为一种储氢材料,写出其与水反应的化学方程式 。
(4)储氢材料的研究很广泛。下列物质中,可作为储氢材料的是 。(填编号)
| A.Ca(OH)2 | B.MgH2 | C.O2 | D.LaNi5 |
 (强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。
(强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。
(1)CaCN2 
(2)CaCO3 CaO+CO2↑ CaCN2+3H2O=CaCO3+2NH3↑
CaO+CO2↑ CaCN2+3H2O=CaCO3+2NH3↑
(3)CaH2+2H2O=Ca(OH)2+2H2↑ (4)B D
(5)取一定量的溶液,滴加AgNO3溶液产生白色沉淀,该沉淀能溶于稀硝酸,说明原溶液中的阴离子是NO2-。
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列物质的转化在给定条件下能实现的是
①氯化钠饱和溶液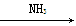
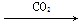 NaHCO3(s)
NaHCO3(s)
②N2 NO2
NO2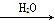 HNO3
HNO3
③海水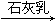 Mg(OH)2
Mg(OH)2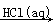 MgCl2(aq)
MgCl2(aq) MgCl2(s)
MgCl2(s)
④Al2O3 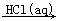 AlCl3(aq)
AlCl3(aq) 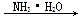 Al(OH)3
Al(OH)3
⑤重晶石(BaSO4) 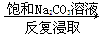 BaCO3
BaCO3 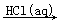 BaCl2(aq)
BaCl2(aq)
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
对下列实验现象的描述不正确的是
| A.光亮的金属Na暴露在空气中,表面逐渐变暗 |
| B.将SO2通入品红溶液,品红溶液褪色 |
| C.将Mg(OH)2固体投入FeCl3溶液中,无明显现象 |
| D.浓硫酸与Cu混合加热,可能有白色固体析出 |
I、铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为: .其电极均由石墨材料做成,则电解时不断消耗的电极是 ;(填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 ;
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH+3H2O═2Na[Al(OH)4]+6Ag,则负极的电极反应式为 ,正极附近溶液的pH (填变大、不变或变小)。
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。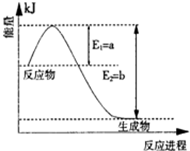
(1)图是在一定温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出合成氨的热化学反应方程: (△H的数值用含字母a、b的代数式表示)。
(2)工业合成氨反应如下,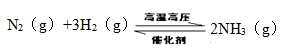
在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:

有3mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:
已知物质开始沉淀和沉淀完全时pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 沉淀开始时pH | 2.7 | 4.1 | 8.3 |
| 沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
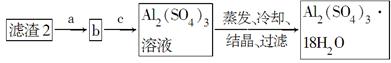
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
(一)、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4x10ˉ6 | 6x 10ˉ6 | 2x10ˉ5 | 4x10ˉ5 | 3x10ˉ5 | 2x10ˉ5 |
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)
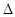 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g) 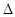 H= -110.5KJ/mol
H= -110.5KJ/mol写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(二)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式______
(2)下列各项中,能说明元素C比E非金属性强的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
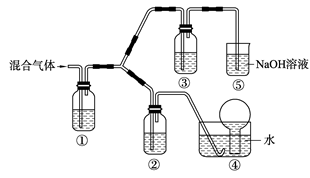
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2=NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应装置②、③中盛放的药品依次是______、______。
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。

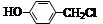 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。