题目内容
(14分)某研究小组对铁生锈进行研究:

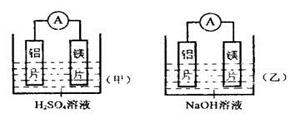
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:

①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用

(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:

①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用
(14分)(1)A, Fe2O3(或 Fe2O3· xH2O)
(2)O2+2 H2O+4e-= 4 OH-
(3)潮湿的空气(或氧气与水); 2Fe +O2 +2 H2O=2 Fe(OH)2
(4)C (5)① Fe2O3+6 H+=2 Fe3++3 H2O
②铁制品表面有红色固体析出③ 3、1、5、3、1、1;B
(2)O2+2 H2O+4e-= 4 OH-
(3)潮湿的空气(或氧气与水); 2Fe +O2 +2 H2O=2 Fe(OH)2
(4)C (5)① Fe2O3+6 H+=2 Fe3++3 H2O
②铁制品表面有红色固体析出③ 3、1、5、3、1、1;B
(1)B、C都不能隔绝空气,防止铁发生电化学腐蚀,而A不能,所以最容易倍腐蚀的是A。铁锈的主要成分是Fe2O3(或 Fe2O3· xH2O)。
(2)在铁的电化学腐蚀中,铁作负极,由于溶液的酸性很弱,所以正极是氧气得到电子,即反应式为O2+2 H2O+4e-= 4 OH-。
(3)铁要腐蚀电化学腐蚀,则必须处在潮湿的空气(或氧气与水),反应的总反应式是2Fe +O2 +2 H2O=2 Fe(OH)2.
(4)由于镀层一旦败损之后容易腐蚀电化学腐蚀,所以作镀金属性比铁强的金属,所以答案选C。
(5)①铁锈的主要成分是氧化铁,和稀硫酸反应的方程式为Fe2O3+6 H+=2 Fe3++3 H2O。
②因为铁的活泼性强于铜,铁能和硫酸铜反应置换出铜,所以铁制品表面有红色固体析出。
③在反应中铁失去电子作还原剂,化合价从0价升高到+2价。氧化剂是亚硝酸钠,氮元素的化合价从+3价降低到-3价,变化6个单位,即氧化剂和还原剂的物质的量之比是1︰3的,所以方程式为3Fe +NaNO2 +5NaOH=3Na2FeO2 +H2O +NH3↑。将3个反应合并即得到12Fe+NaNO3+4NaNO2+10H2O=4Fe3O4+5NH3↑+5NaOH,这说明反应中消耗的是硝酸钠和亚硝酸钠,所以需要补充二者,答案选B。
(2)在铁的电化学腐蚀中,铁作负极,由于溶液的酸性很弱,所以正极是氧气得到电子,即反应式为O2+2 H2O+4e-= 4 OH-。
(3)铁要腐蚀电化学腐蚀,则必须处在潮湿的空气(或氧气与水),反应的总反应式是2Fe +O2 +2 H2O=2 Fe(OH)2.
(4)由于镀层一旦败损之后容易腐蚀电化学腐蚀,所以作镀金属性比铁强的金属,所以答案选C。
(5)①铁锈的主要成分是氧化铁,和稀硫酸反应的方程式为Fe2O3+6 H+=2 Fe3++3 H2O。
②因为铁的活泼性强于铜,铁能和硫酸铜反应置换出铜,所以铁制品表面有红色固体析出。
③在反应中铁失去电子作还原剂,化合价从0价升高到+2价。氧化剂是亚硝酸钠,氮元素的化合价从+3价降低到-3价,变化6个单位,即氧化剂和还原剂的物质的量之比是1︰3的,所以方程式为3Fe +NaNO2 +5NaOH=3Na2FeO2 +H2O +NH3↑。将3个反应合并即得到12Fe+NaNO3+4NaNO2+10H2O=4Fe3O4+5NH3↑+5NaOH,这说明反应中消耗的是硝酸钠和亚硝酸钠,所以需要补充二者,答案选B。

练习册系列答案
相关题目

 xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
