题目内容
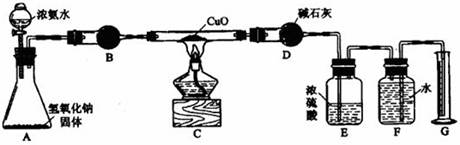
(8分)用下图所示的实验过程,测定含Na2SO4的亚硫酸钠中Na2SO3 的质量分数。

测定沉淀(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是 ,沉淀乙是 ;
(2)试剂B溶液选用稀盐酸,不能选用稀硝酸的原因是 ;
(3)沉淀甲与试剂B反应的离子方程是 ;
(4)计算含Na2SO4的亚硫酸钠中Na2SO3 的质量数 。

测定沉淀(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是 ,沉淀乙是 ;
(2)试剂B溶液选用稀盐酸,不能选用稀硝酸的原因是 ;
(3)沉淀甲与试剂B反应的离子方程是 ;
(4)计算含Na2SO4的亚硫酸钠中Na2SO3 的质量数 。
(1)BaCl2或Ba(OH)2溶液; BaSO4
(2)硝酸能把BaSO3氧化成 BaSO4
(3)
(4)
(2)硝酸能把BaSO3氧化成 BaSO4
(3)

(4)

本题重点考察学生对硫酸盐和亚硫酸盐性质的掌握程度。取固体加入蒸馏水之后,获得了Na2SO4和Na2SO3的水溶液,当向其中加入过量A时产生了沉淀,由于高中化学中BaSO4是一种常见的沉淀,学生很容易会想的加入了Ba2+ 所以试剂A中含有Ba2+ ,可以为BaCl2或Ba(OH)2溶液,同时由此可判断沉淀甲为BaSO4和BaSO3的混合物,溶液乙为NaCl,由于加入试剂 B后产生了溶液和沉淀乙,说明沉淀可能部分发生了溶解,结合沉淀物的性质可判断溶剂B为酸,亚硫酸钡溶于酸,而硫酸钡不溶于酸。
(1)试剂A是BaCl2或Ba(OH)2溶液;沉淀乙不溶于试剂B所以沉淀是BaSO4
(2))硝酸具有强氧化性会将亚硫酸钡氧化为硫酸钡,这样无法分离出混合沉淀中原有的硫酸钡,最后无法计算样品中亚硫酸钠的质量分数。
(3)沉淀甲为BaSO4和BaSO3的混合物,当向其中加入酸时会与BaSO3会与酸反应离子反应方程式为
(4)根据反应后剩下沉淀乙硫酸钡的质量计算出其物质的量W1,反应过程中硫酸根离子物质的量守恒可以得出混合物样品中硫酸钠的物质的量,进而求出硫酸钠的质量,用总质量减去硫酸钠的质量即可求出亚硫酸钠的质量,即
(1)试剂A是BaCl2或Ba(OH)2溶液;沉淀乙不溶于试剂B所以沉淀是BaSO4
(2))硝酸具有强氧化性会将亚硫酸钡氧化为硫酸钡,这样无法分离出混合沉淀中原有的硫酸钡,最后无法计算样品中亚硫酸钠的质量分数。
(3)沉淀甲为BaSO4和BaSO3的混合物,当向其中加入酸时会与BaSO3会与酸反应离子反应方程式为

(4)根据反应后剩下沉淀乙硫酸钡的质量计算出其物质的量W1,反应过程中硫酸根离子物质的量守恒可以得出混合物样品中硫酸钠的物质的量,进而求出硫酸钠的质量,用总质量减去硫酸钠的质量即可求出亚硫酸钠的质量,即


练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目