题目内容
8.下列对一些事实的理论解释正确的是( )| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层有8个电子而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| D | 纯碱溶液能使湿润的紫色石蕊试纸变蓝色 | 纯碱能电离出OH-而使石蕊试纸变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.原子或离子最外层达到稳定结构时较稳定;
B.离子晶体中含有自由移动的离子时能导电;
C.钾原子比钠原子最外层都只有1个电子,但K原子比Na原子的半径大;
D.纯碱溶液由于碳酸根水解成碱性,所以能使湿润的紫色石蕊试纸变蓝色.
解答 解:A.原子或离子最外层达到稳定结构时较稳定,钠离子最外层有8个电子处于稳定结构、Na原子最外层只有一个电子而易失去,所以钠离子性质比钠原子稳定,故A正确;
B.离子晶体中含有自由移动的离子时能导电,NaCl是离子晶体,晶体时没有自由移动的离子、熔融状态下含有自由移动的离子,所以熔融状态下导电、晶体不导电,故B错误;
C.钾原子比钠原子最外层都只有1个电子,但K原子比Na原子的半径大,所以钾原子比钠原子更易失去电子,故C错误;
D.纯碱溶液由于碳酸根水解成碱性,所以能使湿润的紫色石蕊试纸变蓝色,不是能电离出OH-而使石蕊试纸变蓝色,故D错误;
故选:A.
点评 本题考查较综合,涉及粒子结构、碳酸钠呈碱性的原因、晶体导电等知识点,侧重考查分析能力,注意离子晶体不导电的原因,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | Cl-的结构示意图 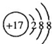 | D. | 质量数为37的氯原子${\;}_{17}^{37}Cl$ |
16.下列物质中,与0.3mol H2O含有相同氢原子数的物质是( )
| A. | 18.9 g HNO3 | B. | 3.612×1024个HCl分子 | ||
| C. | 0.2 mol H3PO4 | D. | 0.2 NA个CH4分子 |
20.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,VL CHCl3含有的碳原子数为$\frac{V}{22.4}$NA | |
| B. | 常温常压下,1mol乙基所含的电子总数为17NA | |
| C. | 12g C60中含有60NA个电子 | |
| D. | 1mol HNO3见光分解,转移电子数为4NA |
17.(双选)下列化学反应中电子转移的表示方法正确的是( )
| A. | 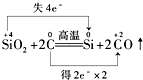 | |
| B. |  | |
| C. |  | |
| D. |  |
18.下列说法正确的是( )
| A. | 水溶液中,1mol KCl和1mol KClO3电离出的氯离子一样多 | |
| B. | 电解质NaHCO3的电离方程式为:NaHCO3═Na++HCO3- | |
| C. | 凡溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 氯化钠溶液在电流作用下,电离成自由移动的钠离子和氯离子 |