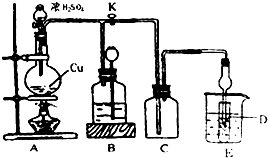
题目内容
13.0.1mol某液态烷烃完全燃烧需要消耗0.8mol氧气,通过计算求该烷烃的化学式.写出一种符合该化学式的烃的结构简式.分析 设烷烃的化学式为CnH2n+2,根据燃烧方程式计算,燃烧方程式为:CnH2n+2+(n+$\frac{2n+2}{4}$)O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O.
解答 解:设烷烃的化学式为CnH2n+2,
CnH2n+2+(n+$\frac{2n+2}{4}$)O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O
1 (n+$\frac{2n+2}{4}$)
0.1 0.8
则有:n+$\frac{2n+2}{4}$=$\frac{0.8}{0.1}$=8,解得n=5,故烷烃化学式为:C5H12.结构简式有三种:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)2C(CH3)2.
答:烷烃分子式为CnH2n+2;结构简式为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)2C(CH3)2.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意从有机物燃烧的化学方程式的角度解答该题.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
1.据报道,美国正在研究的锌电池可能取代目 前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2═2ZnO,原料是锌粒、电解质溶液、空气.下列叙述中正确的是( )
| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
8.下列对一些事实的理论解释正确的是( )
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层有8个电子而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| D | 纯碱溶液能使湿润的紫色石蕊试纸变蓝色 | 纯碱能电离出OH-而使石蕊试纸变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
18.按要求写出以下方程式:
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
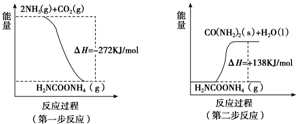
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式: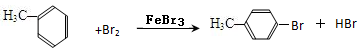 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
5.下列各组离子在指定的溶液中不能大量共存的是( )
| A. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| B. | 1 mol•L-1的烧碱溶液中:S2-、SO32-、SO42-、K+ | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:Cs+、Ba2+、S2-、Cl- | |
| D. | 含有大量HCO3-的澄清透明溶液中:K+、NH4+、SO42-、MnO4- |
3.铝硅合金(含Si13.5%)在凝固时收缩率很小,因而这种合金适合铸造.有下列三种物质:①铝 ②硅 ③铝硅合金,它们的熔点由低到高的顺序是( )
| A. | ①③② | B. | ②①③ | C. | ③②① | D. | ③①② |