题目内容
【题目】已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为_____________________
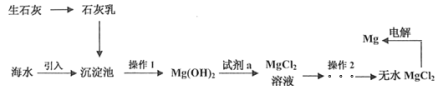
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。

这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
_________接__________ ,________接__________,___________ 接_______________。
【答案】![]() g c(或d) d(或c) a b f
g c(或d) d(或c) a b f
【解析】
(1)C与浓硫酸在加热条件下反应,生成二氧化碳、二氧化硫和水。
(2)装置①的作用分别是检验SO2的存在、除去SO2、检验SO2是否除尽;装置②的作用是检验水蒸气的存在;装置③的作用是检验CO2的存在;装置④的作用是制取SO2。因为检验SO2、检验CO2,都需经过溶液,所以检验反应产生的水蒸气,应在检验SO2、CO2之前进行。
(1)C与浓硫酸在加热条件下反应,生成二氧化碳、二氧化硫和水,反应方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O。答案为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(2)依据实验设计的要求,装置的连接顺序为:制取SO2、检验水蒸气的存在、检验SO2的存在,检验CO2的存在。由此确定仪器接口的连接顺序为:g接c(或d),d(或c)接a,b接f。答案为:g;c(或d);d(或c);a;b;f。

【题目】维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01 mol HCl气体 | 加入0.01 mol NaOH固体 | |
i.1 L H2O | 7 | a | 12 |
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液 | 4.76 | 4.67 | 4.85 |
①a=____________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:____________。
③试剂ii中微粒浓度关系正确的有____________(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是____________(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
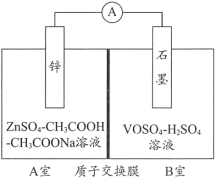
Zn+2VOSO4+2H2SO4![]() ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)____________(填“增大”“减小”或“不变”),结合化学用语说明理由:______。
②充电时,A室中的c(H+)变化缓慢的原因是____________。
【题目】已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
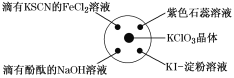
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变成蓝色 | Cl2具有氧化性 |
A.AB.BC.CD.D