��Ŀ����
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ�ص��ڵ����е����ķ���Ϊ��______(��a��b��ʾ)��
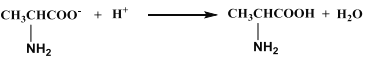
��2��������ӦʽΪ______��������ӦʽΪ___________��
��3���õ�ع���ʱ��H2��O2�������ⲿ����,��ؿ����������ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
�� 2Li+H2![]() 2LiH �� LiH+H2O=LiOH+H2��
2LiH �� LiH+H2O=LiOH+H2��
�ٷ�Ӧ���еĻ�ԭ����_________����Ӧ���е���������_____��
����֪LiH�����ܶ�Ϊ0.82g��cm-3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ______��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ___mol��
���𰸡���b��a 2H2+4OH--4e-=4H2O��H2+2OH--2e-=2H2O O2 + 2H2O + 4e-=4OH- Li H2O ![]() ��8.71��10-4 32
��8.71��10-4 32
��������
(1)ԭ�����Ҫ�ǽ���ѧ��ת��Ϊ���ܣ�����ʧȥ���ӣ�Ϊ����,������õ��ӣ�Ϊ�����������ɸ���ͨ����������������
(2)����������ʧ���Ӻ����������ӷ�Ӧ����ˮ��
(3)�ٸ��ݻ��ϼ۵ı仯�жϣ�����LiH������ΪvL��������������ʵ�������������������۸���ʵ�ʲμӷ�Ӧ�������Լ��缫��Ӧʽ���㡣
(1)ȼ�ϵ����ԭ��أ��ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ʧȥ���ӣ�Ϊ������������õ��ӣ�Ϊ�����������ɸ���ͨ��������������������a��b��
(2)����������ʧ���Ӻ����������ӷ�Ӧ����ˮ���缫��ӦʽΪ2H2+4OH--4e-=4H2O��H2+2OH--2e-=2H2O������Ϊ�����õ����ӣ����ڵ������ҺΪ���ԣ������õ����Ӻ�ˮ����OH-������ʽΪO2 + 2H2O + 4e-=4OH-��
(3) 2Li+H2![]() 2LiH���⻯��У�Li�Ļ��ϼ�Ϊ+1����Ӧ���ʧ���ӷ���������Ӧ����ǻ�ԭ������ LiH+H2OLiOH+H2�����÷�Ӧ��H2O�õ�������������������ԭ��Ӧ��H2O����������
2LiH���⻯��У�Li�Ļ��ϼ�Ϊ+1����Ӧ���ʧ���ӷ���������Ӧ����ǻ�ԭ������ LiH+H2OLiOH+H2�����÷�Ӧ��H2O�õ�������������������ԭ��Ӧ��H2O����������
�ڸ��ݻ�ѧ��Ӧ����ʽ��2n(H2)=n(LiH)���������224 LH2��Ϊ10mol�������ɵ�LiHΪ20mol��������Ϊ20mol��(7��1)=160g��![]() �����ɵ�LiH����뱻���յ�H2�����Ϊ195cm3:224L��8.7��10��4��
�����ɵ�LiH����뱻���յ�H2�����Ϊ195cm3:224L��8.7��10��4��
��20molLiH��������20molH2��ʵ�ʲμӷ�Ӧ��H2Ϊ20mol%80%=16mol��1molH2ת��Ϊ1molH2O��ת��2mol���ӣ�����16molH2��ת��32mol�ĵ��ӡ�