题目内容
以石墨做电极,电解1 mol/L下列物质的水溶液,下列表述正确的是
| A.若为盐酸,pH减小 | B.若为氢氧化钠溶液,pH减小 |
| C.若为硫酸钠溶液,pH不变 | D.若为氯化钠溶液,pH不变 |
C
解析试题分析:A、以石墨做电极电解盐酸,溶液中氢离子、氯离子放电,HCl的浓度逐渐减小,PH值逐渐变大,错误;B、以石墨做电极电解氢氧化钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中氢氧化钠的浓度增大,溶液的PH值增大,错误;C、以石墨做电极电解硫酸钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中硫酸钠的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,溶液的pH值保持不变,正确;D、以石墨做电极电解氯化钠溶液,溶液中氢离子和氯离子放电,溶液中氢离子浓度逐渐减小,氢氧根浓度增大,PH值变大,错误。
考点:考查电解原理及离子的放电顺序。

练习册系列答案
相关题目
将下图所示实验装置的K闭合,下列判断错误的是
| A.盐桥中的K+移向乙池 |
B.电子沿Zn a a b b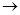 Cu路径流动 Cu路径流动 |
| C.b电极上的反应式为4OH-—4e-=O2↑+2H2O |
| D.片刻后可观察到滤纸a点变红色 |
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是
| A.a电极附近呈红色,b电极附近呈蓝色 |
| B.a电极附近呈蓝色,b电极附近呈红色 |
| C.逸出气体的体积,a电极的大于b电极的 |
| D.a、b两电极都逸出无色无味气体 |
观察下列几个装置示意图,有关叙述正确的是:
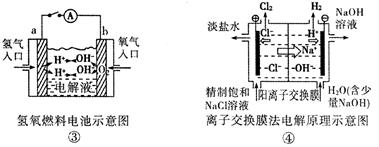
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图,有关说法正确的是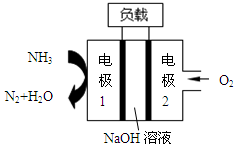
| A.电池工作时,Na+ 向负极移动 |
| B.电子由电极2经外电路流向电极1 |
| C.电池总反应为:4NH3+3O2=2N2+6H2O |
| D.电极2发生的电极反应为:O2+ 4H + + 4e-=2H2O |
关于下列各装置图的叙述中,不正确的是 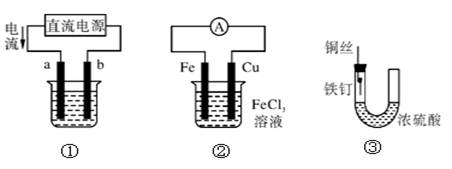
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.用装置①进行电镀,镀件接在b极上 |
| C.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| D.装置③中的铁钉几乎没被腐蚀 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
| A.放电时负极附近溶液的pH不变 |
| B.放电时电解质溶液中的OH-向正极移动 |
| C.充电时电池的负极应与电源的负极相连接 |
| D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
下列有关金属的说法正确的是( )
| A.不锈钢不易生锈是因为表面有致密保护层 |
| B.纯银的器皿在空气中久置表面变暗是因为发生电化学腐蚀 |
| C.当镀锌铁制品的镀层破损时,镀层还能对铁制品起保护作用 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
关于铜电极的叙述中不正确的是
| A.铜锌原电池中铜是正极 |
| B.在镀件上镀铜时可用金属铜作阳极 |
| C.用电解法精炼铜时粗铜做阳极 |
| D.用电解法精炼铜时纯铜做阳极 |