题目内容
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
⑴2Fe3++Cu=2Fe2++Cu2+ 取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明仍存在Fe3+ (合理即得分)
⑵回收铜 加盐酸反应后过滤
⑶FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (每空2分)
⑵回收铜 加盐酸反应后过滤
⑶FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (每空2分)
试题分析:(1)对离子方程式的书写,应注意配平。该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。检验铁离子的存在应用KSCN溶液。注意语言的描述“取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明仍存在Fe3+”
(2)加入铁屑的主要目的是除去铜离子,回收铜单质。因铜不溶于酸溶液,因此可滴加稀盐酸,使多余的铁反应,从而得到铜单质。
(3)过程Ⅱ加入了石灰水,同时还鼓入了空气,因此发生的反应为FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3。
点评:本题主要考查了金属的相关性质及其化学方程式的书写。书写化学方程式时,应注意化学方程式的配平。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目


 O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
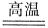 2Fe+3CO
2Fe+3CO ,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol
,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol  ,则转移了_____mol电子,生成的CO
,则转移了_____mol电子,生成的CO