题目内容
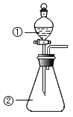
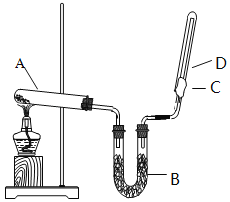
【题目】如图所示,实验室用NH4Cl和Ca(OH)2制取NH3。试回答下列问题:
(1)B处的药品是_____(填“浓硫酸”或“碱石灰”)
(2)检验D处试管中NH3是否收集满,可以用湿润的_____色石蕊试纸(填“红”或“蓝”)。
(3)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成1 L溶液,所得溶液的物质的量浓度为_____。
(4)A处反应的化学方程式是_____。
四、推断题
【答案】碱石灰 红 0.1mol/L 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
(1)制备的氨气中含有水蒸气,需要用碱石灰吸收;
(2)氨气是碱性气体需要用湿润的红色石蕊试纸验满;
(3)根据![]() 进行计算;
进行计算;
(4)实验室制备氨气的原理是利用固体氯化铵和氢氧化钙加热反应生成。
(1)装置图分析可知,生成的氨气中含有水蒸气,氨气是碱性气体需要通过碱石灰吸收水蒸气,对氨气进行干燥;故答案为:碱石灰;
(2)氨气是碱性气体需要用湿润的红色石蕊试纸验满;故答案为:红;
(3)2.24 L的氨气的物质的量为0.1mol,c=![]() =
=![]() =0.1mol/L;
=0.1mol/L;
(4)A处发生反应是实验室制备氨气的反应,利用氢氧化钙和氯化铵加热反应生成氨气,反应的化学方程式2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。