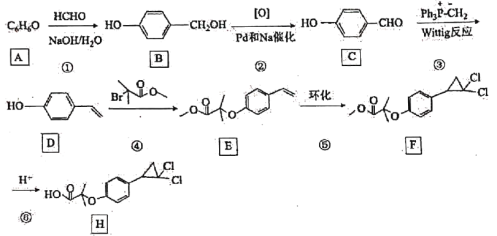
题目内容
【题目】(1)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为_____。
(2)把Na2CO3和NaHCO3的混合物29.6g加热到质量不再变化时,得残留固体26.5g;则原混合物中Na2CO3的物质的量为:_____。
【答案】2:3 0.2mol
【解析】
(1)设已反应的Fe3+的物质的量为2mol,则:根据方程式Fe+2Fe3+=3Fe2+可知溶液中Fe2+的物质的量为3mol,溶液中的Fe3+和Fe2+浓度相等,所以未反应的Fe3+的物质的量为3mol,则已反应的Fe3+和未反应的Fe3+的物质的量之比为2mol:3mol=2:3,故答案为:2:3;
(2)设NaHCO3的物质的量为x,
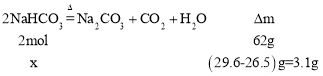
x=![]() =0.1mol,
=0.1mol,
混合物中碳酸氢钠的质量为:m(NaHCO3)=0.1 mol×84g/mol=8.4g,
混合物中碳酸钠的物质的量为:n(Na2CO3)=![]() =0.2mol,
=0.2mol,
故答案为:0.2mol。

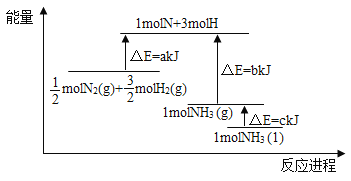
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1;途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1;2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1;2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
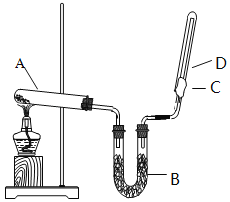
II、利用如图所示装置测定中和热的实验步骤如下:
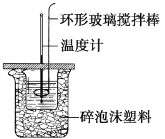
①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.1 | 20.1 | 24.2 |
4 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=____kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。