题目内容
(2012?江苏)化合物H 是合成药物盐酸沙格雷酯的重要中间体,其合成路线如下:

(1)化合物A 中的含氧官能团为
(2)反应①→⑤中,属于取代反应的是
(3)写出同时满足下列条件的B 的一种同分异构体的结构简式: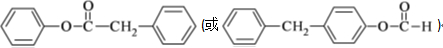
 .
.
I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应.
(4)实现D→E 的转化中,加入的化合物X 能发生银镜反应,X 的结构简式为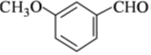
 .
.
(5)已知: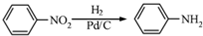 化合物
化合物 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以 和
和 为原料制备该化合物的合成路线流程图
为原料制备该化合物的合成路线流程图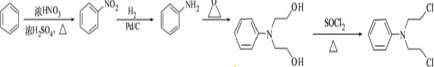
 (无机试剂任用).
(无机试剂任用).
合成路线流程图示例如下:

(1)化合物A 中的含氧官能团为
羟基
羟基
和醛基
醛基
(填官能团名称).(2)反应①→⑤中,属于取代反应的是
①③⑤
①③⑤
(填序号).(3)写出同时满足下列条件的B 的一种同分异构体的结构简式:


I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应.
(4)实现D→E 的转化中,加入的化合物X 能发生银镜反应,X 的结构简式为


(5)已知:
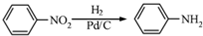 化合物
化合物 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以 和
和 为原料制备该化合物的合成路线流程图
为原料制备该化合物的合成路线流程图

合成路线流程图示例如下:

分析:合成H的各物质都在合成图中,由碳链骨架和官能团的变化可知,反应①为取代反应,反应②为还原反应,反应③为取代反应,反应④为加成反应,反应⑤为取代反应;
(1)A为邻羟基苯甲醛,含有-OH、-CHO;
(2)根据以上分析判断反应类型;
(3)B为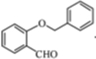 ,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构;
,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构;
(4)D为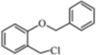 ,E为
,E为 ,D与X反应生成E,X能发生银镜反应,X一定含-CHO;
,D与X反应生成E,X能发生银镜反应,X一定含-CHO;
(5) 先发生硝化反应生成硝基苯,再还原为苯胺,然后与
先发生硝化反应生成硝基苯,再还原为苯胺,然后与 反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物.
反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物.
(1)A为邻羟基苯甲醛,含有-OH、-CHO;
(2)根据以上分析判断反应类型;
(3)B为
 ,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构;
,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构;(4)D为
 ,E为
,E为 ,D与X反应生成E,X能发生银镜反应,X一定含-CHO;
,D与X反应生成E,X能发生银镜反应,X一定含-CHO;(5)
 先发生硝化反应生成硝基苯,再还原为苯胺,然后与
先发生硝化反应生成硝基苯,再还原为苯胺,然后与 反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物.
反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物.解答:解:合成H的各物质都在合成图中,由碳链骨架和官能团的变化可知,反应①为取代反应,反应②为还原反应,反应③为取代反应,反应④为加成反应,反应⑤为取代反应;
(1)A为邻羟基苯甲醛,含有-OH、-CHO,名称分别为羟基、醛基,故答案为:羟基;醛基;
(2)根据以上分析可知①③⑤为取代反应,故答案为:①③⑤;
(3)B为 ,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构,符合条件的同分异构体为
,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构,符合条件的同分异构体为 ,
,
故答案为: ;
;
(4)D为 ,E为
,E为 ,D与X反应生成E,X能发生银镜反应,X一定含-CHO,则X的结构简式为
,D与X反应生成E,X能发生银镜反应,X一定含-CHO,则X的结构简式为 ,
,
故答案为: ;
;
(5) 先发生硝化反应生成硝基苯,再还原为苯胺,然后与
先发生硝化反应生成硝基苯,再还原为苯胺,然后与 反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物,则合成路线流程图为
反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物,则合成路线流程图为 ,
,
故答案为: .
.
(1)A为邻羟基苯甲醛,含有-OH、-CHO,名称分别为羟基、醛基,故答案为:羟基;醛基;
(2)根据以上分析可知①③⑤为取代反应,故答案为:①③⑤;
(3)B为
 ,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构,符合条件的同分异构体为
,其一种同分异构体满足I.分子中含有两个苯环;II.分子中有7 种不同化学环境的氢;III.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应,则该有机物中不含酚羟基,含2个苯环及酯的结构,且水解后生成苯酚结构,符合条件的同分异构体为 ,
,故答案为:
 ;
;(4)D为
 ,E为
,E为 ,D与X反应生成E,X能发生银镜反应,X一定含-CHO,则X的结构简式为
,D与X反应生成E,X能发生银镜反应,X一定含-CHO,则X的结构简式为 ,
,故答案为:
 ;
;(5)
 先发生硝化反应生成硝基苯,再还原为苯胺,然后与
先发生硝化反应生成硝基苯,再还原为苯胺,然后与 反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物,则合成路线流程图为
反应生成的物质,该物质再与SOCl2在加热条件下反应得到产物,则合成路线流程图为 ,
,故答案为:
 .
.点评:本题考查有机物的合成,明确合成图中物质的结构与性质的关系、碳链结构与官能团的变化等即可解答,题目难度中等,(5)为解答的难点,注意结合信息来分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
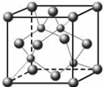 (2012?江苏一模)A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
(2012?江苏一模)A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空: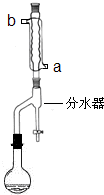 (2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
(2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
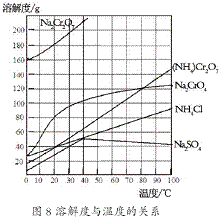 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下: