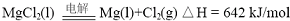题目内容
 (2012?江苏一模)A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
(2012?江苏一模)A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)A的最高价氧化物对应的水化物分子中其中心原子采取
sp2
sp2
杂化.(3)已知A、C形成的化合物分子甲与B的单质分子结构相似,1mol甲中含有π键的数目为
2NA(或1.204×1024)
2NA(或1.204×1024)
.(4)D的核外电子排布式是
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
,它的高价离子与B的简单氢化物形成的配离子的化学式为[Cu(NH3)4]2+
[Cu(NH3)4]2+
.(5)D的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式
2CuH+3Cl2
2CuCl2+2HCl
| ||
2CuH+3Cl2
2CuCl2+2HCl
.
| ||
分析:A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,据此解答.
解答:解:A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,
(1)C、N、S元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(2)H2CO3中C原子最外层电子数全部成键,没有孤电子对,成1个C=O双键,2个C-O单键,杂化轨道数目为3,采取sp2杂化,故答案为:sp2;
(3)C、O形成的化合物分子甲与N的单质分子结构相似,1mol氮气分子中含有2molπ键,所以1mol甲中含有π键的数目为2NA(或1.204×1024),故答案为:2NA(或1.204×1024);
(4)D的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1,一个铜离子和四个氨气分子形成配合物离子铜氨离子,其化学式为:[Cu(NH3)4]2+,
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1),[Cu(NH3)4]2+,
(5)该晶胞中铜离子和氢离子个数比是1:1,所以其化学式为CuH,氯气有强氧化性,氢化亚铜有强还原性,氯气能把氢化亚铜氧化生成氯化铜和氯化氢,所以氢化亚铜在氯气中燃烧的方程式为:2CuH+3Cl2
2CuCl2+2HCl,
故答案为:2CuH+3Cl2
2CuCl2+2HCl.
(1)C、N、S元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(2)H2CO3中C原子最外层电子数全部成键,没有孤电子对,成1个C=O双键,2个C-O单键,杂化轨道数目为3,采取sp2杂化,故答案为:sp2;
(3)C、O形成的化合物分子甲与N的单质分子结构相似,1mol氮气分子中含有2molπ键,所以1mol甲中含有π键的数目为2NA(或1.204×1024),故答案为:2NA(或1.204×1024);
(4)D的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1,一个铜离子和四个氨气分子形成配合物离子铜氨离子,其化学式为:[Cu(NH3)4]2+,
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1),[Cu(NH3)4]2+,
(5)该晶胞中铜离子和氢离子个数比是1:1,所以其化学式为CuH,氯气有强氧化性,氢化亚铜有强还原性,氯气能把氢化亚铜氧化生成氯化铜和氯化氢,所以氢化亚铜在氯气中燃烧的方程式为:2CuH+3Cl2
| ||
故答案为:2CuH+3Cl2
| ||
点评:本题以元素的推断考查了原子的杂化方式、核外电子排布规律、电离能、晶胞计算、配合物等知识点,注意同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族的异常,为易错点.

练习册系列答案
相关题目


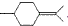 ,则异蒲勒醇的结构简式为
,则异蒲勒醇的结构简式为
 的合成路线流程图.(无机试剂任用,合成路线流程图示例如下:
的合成路线流程图.(无机试剂任用,合成路线流程图示例如下: )
)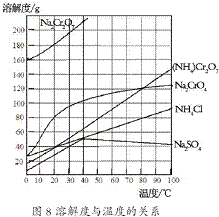 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下: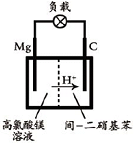 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有: