题目内容
7. 已知元素X,Y,Z在周期表中的相对位置如图所示,Y元素基态原子的价电子排布为nsn-1npn+1,则下列说法错误的是( )
已知元素X,Y,Z在周期表中的相对位置如图所示,Y元素基态原子的价电子排布为nsn-1npn+1,则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Z元素基态原子的核外电子排布式为[Ar]3d104s24p3 | |
| C. | Y的氧化物空间构型可能为V型 | |
| D. | 三种元素的最高价氧化物对应水化物酸性最强的是X |
分析 Y元素基态原子的价电子排布为nsn-1npn+1,由于s能级最多容纳2个电子,且P能级已填充电子,故n-1=2,则n=3,故Y为S元素,由元素X、Y、Z在周期表中的相对位置,可知X为F元素,Z为As元素.
A.由于最外层电子数≤周期数为金属元素,故每一周期容纳主族金属元素为周期数(第一周期除外),则每一周期容纳非金属元素种数为8-周期数;
B.Z为As元素,处于第四周期ⅤA族;
C.Y的氧化物为SO2、SO3,计算S原子价层电子对数、孤电子对数确定空间构型;
D.F元素没有最高价含氧酸.
解答 解:Y元素基态原子的价电子排布为nsn-1npn+1,由于s能级最多容纳2个电子,且P能级已填充电子,故n-1=2,则n=3,故Y为S元素,由元素X、Y、Z在周期表中的相对位置,可知X为F元素,Z为As元素.
A.由于最外层电子数≤周期数为金属元素,故每一周期容纳主族金属元素为周期数(第一周期除外),则每一周期容纳非金属元素为种数8-周期数,故第二周期容纳非金属元素最多,故A正确;
B.Z为As元素,处于第四周期ⅤA族,基态原子的核外电子排布式为[Ar]3d104s24p3,故B正确;
C.Y的氧化物为SO2、SO3,SO2中S原子孤电子对数为$\frac{6-2×2}{2}$=1,价层电子对数为2+1=3,为V型结构,SO3中S原子孤电子对数为$\frac{6-2×3}{2}$=0,价层电子对数为3+0=3,为平面三角形结构,故C正确;
D.F元素没有最高价含氧酸,故D错误,
故选D.
点评 本题考查结构性质位置关系应用,根据外围电子排布推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
17.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下:
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
| 甲 | C3H6O2 | -98 | 47.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 87 | 0.90 | 可溶 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
18.将纯铁片和纯钢片按如图所示插入同浓度的稀硫酸中一段时间,下列说法正确的是( )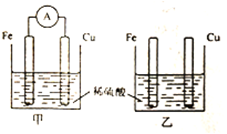

| A. | 甲装置中电能转化为化学能 | |
| B. | 两个装置中铜片表面均有气泡产生 | |
| C. | 甲装置中铜片表面发生了还原反应 | |
| D. | 甲装置中负极上发生的电极反应为Fe-3e-═Fe3+ |
2.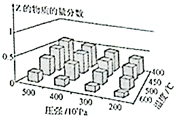 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A. | 在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大 | |
| B. | 升高温度,正、逆反应速率都增大,平衡常数增大 | |
| C. | △H<0 m+n>c | |
| D. | △H>0 m+n<c |
19.W、X、Y、Z为四种短周期元素,X、Z同主族,已知X的原子半径大于Z的原子半径,W的最高正价氧化物对应水化物比Y的最高价氧化物对应水化物的碱性强,Y的阳离子、W的阳离子、Z的阴离子具有相同的电子层结构,下列叙述正确的是( )
| A. | 原子半径:W>X>Y>Z | |
| B. | 单质与盐酸反应速率:Y>W | |
| C. | X最低价氢化物的稳定性强于Z最低价氢化物 | |
| D. | 原子序数:X>W>Y>Z |
16.某气态烷烃和一气态单烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L,通入足量的溴水,溴水的质量增加2.8g,此2种烃是( )
| A. | 甲烷和丙烯 | B. | 甲烷和2-丁烯 | ||
| C. | 甲烷和2-甲基丙烯 | D. | 乙烯和1-丁烯 |
7.下列物质电子式书写正确的是( )
| A. | 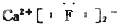 | B. | 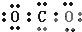 | C. | 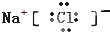 | D. | 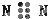 |
 图是X、Y、Z三种物质的溶解度曲线,
图是X、Y、Z三种物质的溶解度曲线,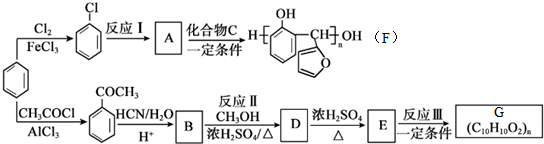
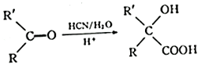
 生成
生成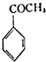 的反应类型是取代反应.
的反应类型是取代反应.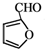 、
、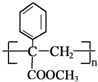 .
. .
.