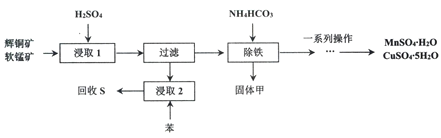
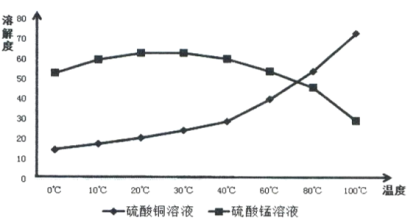
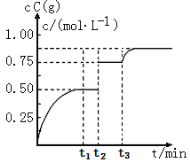
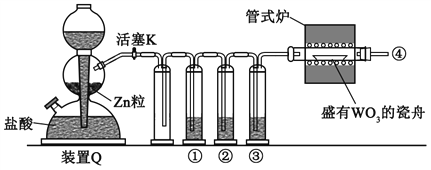
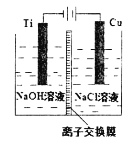题目内容
【题目】氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-89.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A.H2(g)B.CO(g)C.C8H18(l)D.CH4(g)
【答案】B
【解析】
热化学方程式,需要注意△H为“-”表示放热反应,负号后面的数字越大,放出的热量就越多;负号后面的数字越小,放出的热量就越少,△H为“+”表示吸热反应.△H的单位一般为kJmol-1(kJ/mol),并利用物质的物质的量与热量成正比来计算。
H2、CO、C8H18、CH4的相对分子质量分别为2、28、114、16,
所以相同质量(假设均是1g)四种物质的物质的量之比为57:4.07:1:7.125,
根据H2(g)+O2(g)=H2O(l)△H=-285.8kJ/mol
CO(g)+O2(g)=CO2(g)△H=-283.0kJ/mol
C8H18(l)+O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
燃烧放出热量之比为(57×285.8):(4.07×283):(1×5518):(7.125×890.3)=16290.6:1151.81:5518:6343.3875,
所以相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最多的是氢气,最少的为CO,
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
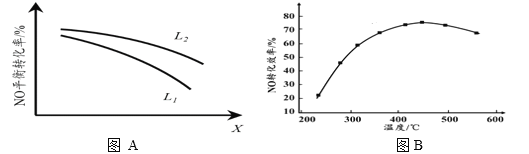
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;