题目内容
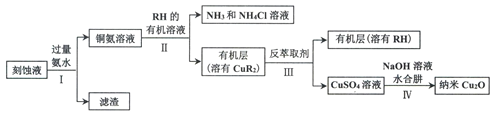
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:
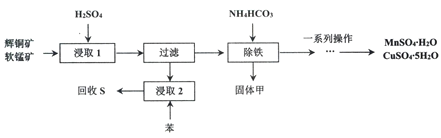
(1)浸取2过程中温度控制在500C~600C之间的原因是__________________。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________(用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体
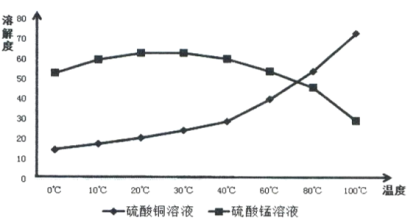
【答案】温度高苯容易挥发,温度低浸取速率小 Cu2S+4Fe3+=2Cu2++S+4Fe2+ NH4Fe3(SO4)2(OH)6 AFB ECD
【解析】
(1)根据苯容易挥发,和温度对速率的影响分析;
(2)根据催化剂的特点分析,参与反应并最后生成进行书写方程式;
(3)根据反应过程中的数据分析各离子的种类和数值,最后计算各种离子的物质的量比即得化学式。
(1)浸取2过程中使用苯作为溶剂,温度控制在500C~600C之间,是温度越高,苯越容易挥发,温度低反应的速率变小。
(2)Fe3+对Mn02氧化Cu2S起着重要催化作用,说明铁离子参与反应,然后又通过反应生成,铁离子具有氧化性,能氧化硫化亚铜,本身被还原为亚铁离子,故第一步反应为Cu2S+4Fe3+=2Cu2++S+4Fe2+,二氧化锰具有氧化性,能氧化亚铁离子。
(3)向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)期0.02mol,过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣,即氧化铁为0.03mol,说明该固体中含有铵根离子和铁离子。向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g硫酸钡,即0.04mol,因为将溶液分成两等份,则19.2 g固体甲含有0.04mol铵根离子,0.12mol铁离子,0.08mol硫酸根离子,则含有的氢氧根离子物质的量为![]() ,则固体甲的化学式为NH4Fe3(SO4)2(OH)6。
,则固体甲的化学式为NH4Fe3(SO4)2(OH)6。

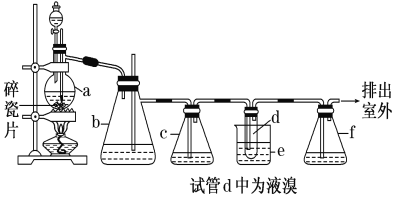
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是________。
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e), 但不用冰水进行过度冷却,原因__________________。
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
k=__________________________。
(3)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:
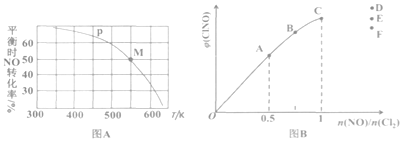
①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在P压强条件下进行,则M点的分压平衡常数KP=________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_______点。