题目内容
(14分)某研究性学习小组在网上收集到如下信息:硫化钠,俗称臭碱,是一种强还原剂,在工业上用途广泛。他们对硫化钠与次氯酸钠的反应进行探究。
【实验】
在次氯酸钠溶液中加入硫化钠溶液,发现溶液始终澄清。
(1)下列有关硫化钠的说法正确的是 。
a. 硫化钠溶液不宜久置,应现用现配
b. 硫化钠溶液中通入SO2有淡黄色浑浊,可证明SO2有氧化性
c. 硫化钠在空气中潮解并不断放出H2S气体,说明酸性:H2CO3>H2S
d. 配制硫化钠溶液时加入少量氢氧化钾
e. 向硫化钠溶液中滴加稀硝酸有臭鸡蛋气味的气体生成
【提出假设】
(2)反应后的溶液中肯定存在Cl-、SO42-和OH-,为探究溶液中可能还存在的其他阴离子(不考虑离子水解及空气中CO2的影响),该学习小组提出如下假设:
假设1:只还存在S2-
假设2:只还存在ClO-
假设3:
【设计实验方案,验证假设】
(3)请写出实验步骤以及预期现象和结论。
限选实验试剂:1 mol? L-1的CuSO4溶液、1 mol? L-1NaOH溶液、淀粉-KI溶液、紫色石蕊试液、酚酞试液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 |
| 步骤:2:另取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 若 , 则假设3成立。 |
【思考与交流】
(4)实验时某同学发现所用硫化钠溶液呈黄色,联想到工业盐酸呈黄色的原因,该同学认为所用硫化钠溶液中混有少量FeCl3。你是否同意该同学的的观点 (填“同意”或“不同意”),请简述理由: 。
(1)a b c(3分)
(2)既不存在S2- 也不存在ClO- (1分)
(3)每空1分,其他合理答案也可,步骤1和步骤2可以对调。实验步骤 预期现象和结论 步骤1: 1 mol/L的CuSO4溶液 溶液中出现黑色沉淀 ,
则假设 1 成立。步骤:2: 1-2滴淀粉KI溶液 若 溶液变蓝 ,
则假设 2 成立。
若 步骤1中没有出现黑色沉淀,步骤2中溶液不变蓝色 ,
则假设3成立。
(4)不同意,(1分) 因为硫化钠具有强还原性,氯化铁具有强氧化性,二者发生氧化还原反应不能共存。(2分)
解析试题分析:(1)a.氧气可以氧化硫离子为硫单质,硫化钠溶液不宜久置,应现用现配,故a正确;b.硫化钠溶液中通入SO2有淡黄色浑浊,生成S单质,SO2中S元素化合价降低,SO2体现氧化性,故b正确;c.空气中潮解并不断放出H2S气体,潮湿的空气中含有碳酸,说明酸性:H2CO3>H2S,故c正确;d.加入KOH溶液,引入钾离子,应加入NaOH,故d错误;e.硝酸具有强氧化性,硫化钠具有强还原性,二者发生氧化还原反应,不能生成硫化氢,故e错误。
(2)S2-、ClO-不能共存,根据假设1、假设2可知,可能既不存在S2- 也不存在ClO-。
(3)步骤1:取少许反应后溶液于试管中,滴加1mol/L的CuSO4溶液,若溶液中出现黑色沉淀,则假设1成立;步骤:2:另取少许反应后溶液于试管中,滴加1-2滴淀粉KI溶液,若溶液变蓝,则假设2成立;若步骤1中没有出现黑色沉淀,步骤2中溶液不变蓝色,则假设3成立。
(4)不同意,硫化钠具有强还原性,氯化铁具有强氧化性,二者发生氧化还原反应不能共存。
考点:本题考查探究实验方案与设计、离子检验。

 阅读快车系列答案
阅读快车系列答案趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子(提示:Ag2SO4微溶于水):
第一步:向溶液中滴加过量的 溶液,其目的是检验CO32-。并将其除去;
第二步:加入过量的Ba(NO3)2,其目的是 ;
第三步:过滤,再向滤液中加入 溶液(填化学式),发生反应的离子方程式 。
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: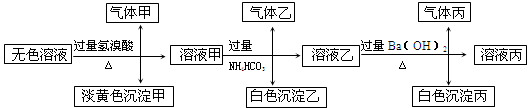
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是 。


 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
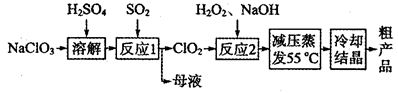
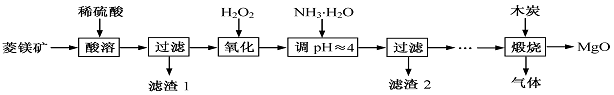 (1)MgCO3与稀硫酸反应的离子方程式为 。
(1)MgCO3与稀硫酸反应的离子方程式为 。 2MgO+2SO2↑+CO2↑、MgSO4+C
2MgO+2SO2↑+CO2↑、MgSO4+C
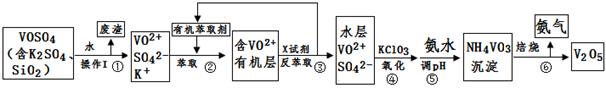
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)