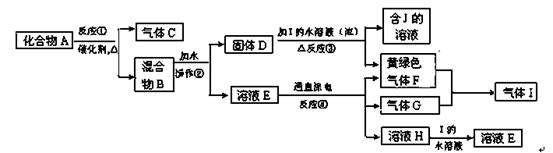
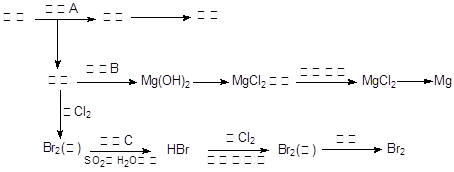题目内容
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下: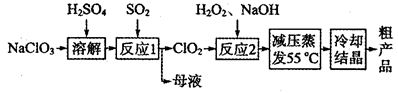
(1)提高“反应l”反应速率的措施有________________________(写出一条即可)。
(2)“反应2”的氧化剂是_____________,该反应的化学方程式为__________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从“母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
(1)适当升高反应温度;增大吸收液浓度等;(2)ClO2;H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;
(3)常压蒸发温度过高,亚硫酸钠容易分解;(4)Na2SO4;(5)过滤
解析试题分析:(1)对于气体和液体的反应,为提高反应速率,可适当升高反应温度;增大吸收液浓度,增大SO2与吸收液的接触面积,
(2)具有氧化性,根据生成NaClO2目标物的特点可知,反应的方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,反应中Cl元素的化合价降低,则ClO2为氧化剂,
(3)减压蒸发在较低温度下可进行,防止常压蒸发温度过高,亚硫酸钠容易分解,
(4)氯酸钠与二氧化硫在酸性条件下发生氧化还原反应生成ClO2和Na2SO4,则母液中应含有Na2SO4,
(5)冷却结晶后要分离出固体,应用过滤的方法
考点:物质的制备实验的工业设计

 阅读快车系列答案
阅读快车系列答案二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
| 沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH值如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的PH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
(1)若下列物质均能把Fe2+氧化为Fe3+,则过程①中可选择加入的氧化剂是 。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)过程②中,所得滤渣的成分是 。
(3)过程③中,搅拌的目的是 ,发生反应的离子方程式是 。
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是___________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 +
 O2 → MnO2 + CO2。
O2 → MnO2 + CO2。现在空气中加热 460.0 g的MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 。(摩尔质量/g·:MnCO3 115 MnO2 87 MnO 71)
(14分)某研究性学习小组在网上收集到如下信息:硫化钠,俗称臭碱,是一种强还原剂,在工业上用途广泛。他们对硫化钠与次氯酸钠的反应进行探究。
【实验】
在次氯酸钠溶液中加入硫化钠溶液,发现溶液始终澄清。
(1)下列有关硫化钠的说法正确的是 。
a. 硫化钠溶液不宜久置,应现用现配
b. 硫化钠溶液中通入SO2有淡黄色浑浊,可证明SO2有氧化性
c. 硫化钠在空气中潮解并不断放出H2S气体,说明酸性:H2CO3>H2S
d. 配制硫化钠溶液时加入少量氢氧化钾
e. 向硫化钠溶液中滴加稀硝酸有臭鸡蛋气味的气体生成
【提出假设】
(2)反应后的溶液中肯定存在Cl-、SO42-和OH-,为探究溶液中可能还存在的其他阴离子(不考虑离子水解及空气中CO2的影响),该学习小组提出如下假设:
假设1:只还存在S2-
假设2:只还存在ClO-
假设3:
【设计实验方案,验证假设】
(3)请写出实验步骤以及预期现象和结论。
限选实验试剂:1 mol? L-1的CuSO4溶液、1 mol? L-1NaOH溶液、淀粉-KI溶液、紫色石蕊试液、酚酞试液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 |
| 步骤:2:另取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 若 , 则假设3成立。 |
【思考与交流】
(4)实验时某同学发现所用硫化钠溶液呈黄色,联想到工业盐酸呈黄色的原因,该同学认为所用硫化钠溶液中混有少量FeCl3。你是否同意该同学的的观点 (填“同意”或“不同意”),请简述理由: 。
化学实验研究的常用方法,
| A.蒸馏 | B.萃取 | C.过滤 | D.结晶 E.分液 F.纸上层析,请填空(填字母): |
用四氯化碳提取溴水中的溴单质的方法 ;
分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)的方法 ;
从含有少量氯化钠的硝酸钾溶液中提取硝酸钾的方法 。
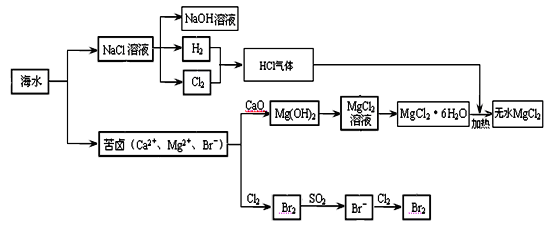
 MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。