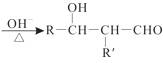题目内容
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(主要成分为Co2O3)制备LiCoO2的工艺流程如图:

资料:在含一定量Cl-的溶液中,Co2+以CoCl42-形式存在:Co2++4C1-![]() CoCl42-
CoCl42-
(1)若“X试剂”是稀H2SO4和H2O2,则H2O2的作用是___。
(2)若“X试剂”是盐酸,写出离子反应方程式___。
(3)途径I中加入NaCl固体的目的___(用平衡移动原理解释)。
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高的原因是___。
(5)已知M是钴的某种氧化物,63.6gCo2(OH)2CO3,煅烧成物质M时转移电子0.4mol,则M的化学式为___;写出“烧结”的化学方程式___。
(6)取mg样品溶于稀硫酸,加入过量KI溶液,再用cmol·L-1Na2S2O3标准液滴定(淀粉溶液做指示剂),达到滴定终点时,消耗Na2S2O3溶液VmL,则产品中钻元素的百分含量为___。
(有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-=S4O62-+2I-)
【答案】作还原剂 Co2O3 +6H+ + 2Cl- = 2Co2++Cl2↑+ 3H2O 加入NaCl固体,溶液中C1-浓度增大,平衡Co2++4C1-![]() CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度 温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少 Co3O4 4Co3O4+6Li2CO3+O2
CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度 温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少 Co3O4 4Co3O4+6Li2CO3+O2![]() 12LiCoO2 +6CO2
12LiCoO2 +6CO2 ![]()
【解析】
原钴矿(主要成分为Co2O3)与稀硫酸和双氧水发生氧化还原反应生成硫酸钴和水,Co2+溶液中加入NaCl固体,致使溶液中氯离子浓度增大,平衡正向移动,洗脱得到CoCl2溶液,加入碳酸铵生成Co2(OH)2CO3,Co2(OH)2CO3在空气中煅烧生成Co3O4,Co3O4和碳酸锂烧结生成LiCoO2。据此解答。
(1)若“X试剂”是稀H2SO4和H2O2,Co2O3与稀H2SO4和H2O2反应生成Co2+,钴化合价降低,则化合价升高H2O2,因此H2O2的作用是作还原剂;故答案为:作还原剂。
(2)若“X试剂”是盐酸,Co2O3与HCl发生氧化还原反应,其离子反应方程式Co2O3 +6H+ + 2Cl- = 2Co2++Cl2↑+ 3H2O;故答案为:Co2O3 +6H+ + 2Cl- = 2Co2++Cl2↑+ 3H2O。
(3)根据图中信息Co2+以CoCl42形式存在:Co2++4C1-![]() CoCl42,因此途径I中加入NaCl固体的目的加入NaCl固体后溶液中C1-浓度增大,平衡Co2++4C1-
CoCl42,因此途径I中加入NaCl固体的目的加入NaCl固体后溶液中C1-浓度增大,平衡Co2++4C1-![]() CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度;故答案为:加入NaCl固体,溶液中C1-浓度增大,平衡Co2++4C1-
CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度;故答案为:加入NaCl固体,溶液中C1-浓度增大,平衡Co2++4C1-![]() CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度。
CoCl42右移,CoCl42浓度增大,提高其在有机溶胺试剂中浓度。
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高,主要是因为温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少;故答案为:温度过高,碳酸铵分解,碳酸铵浓度降低,沉淀质量减少。
(5)已知M是钴的某种氧化物,63.6g Co2(OH)2CO3即物质的量为0.3 mol,则有+2价的钴0.6mol,煅烧成物质M时转移电子0.4mol,说明有0.4mol+2价钴升高变为+3价钴,还有0.2mol钴化合价未变,即得到M的化学式为Co3O4;因此“烧结”的化学方程式4Co3O4+6Li2CO3+O2![]() 12LiCoO2 +6CO2;故答案为:4Co3O4+6Li2CO3+O2
12LiCoO2 +6CO2;故答案为:4Co3O4+6Li2CO3+O2![]() 12LiCoO2 +6CO2。
12LiCoO2 +6CO2。
(6)根据方程式可得关系式LiCoO2~S2O32,得到n(Co) = cmol·L1×V×103L = cV×103mol,则产品中钴元素的百分含量为![]() ;故答案为:
;故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案