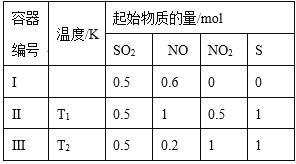
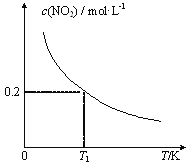
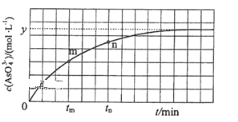
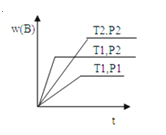
题目内容
【题目】实验测得25℃、101 kPa时,1 mol甲醇完全燃烧释放726.51kJ的热量,下列热化学方程式书写正确的是( )
A. 2CH3OH+3O2=2CO2+4H2O ΔH=-1453.02 kJ·mol-1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=+1453.02 kJ·mol-1
C. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51 kJ·mol-1
D. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-726.51 kJ·mol-1
【答案】C
【解析】
试题在25℃、101 kPa下,0.1 mol甲醇燃烧生成CO2和液态水时放热72.65 kJ,则1mol甲醇燃烧生成CO2和液态水时放热726.5 kJ,所以热化学方程式是CH3OH (l)+![]() O2(g) = CO2(g)+2H2O(l) ΔH=-726.5 kJ/mol,选项C符合题意。
O2(g) = CO2(g)+2H2O(l) ΔH=-726.5 kJ/mol,选项C符合题意。

 阅读快车系列答案
阅读快车系列答案【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
沸点(℃) | -252.8 | -146 | -103.7 | -47.4 | 80.10 | 110.63 | 4827 |
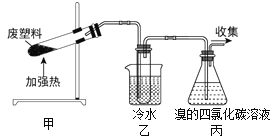
(1)甲试管中最终残留物是_____________。它有多种用途,如下列转化就可制取聚乙炔。写出反应②的化学方程式__________________________ 。
![]()
(2)乙中试管收集到的两种产品中,有一种能使酸性高锰酸钾溶液褪色的物质,该物质为__________。
(3)丙中锥形瓶观察到的现象_____________________________________。反应的化学方程式是__________________________、_________________________。
(4)经溴的四氯化碳溶液充分吸收,最后收集到的气体是______________。