题目内容
15.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下 11.2 L NO与11.2L O2混合,充分反应后所含分子数为0.75NA | |
| C. | 标准状况下,22.4 LCO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
分析 A、标况下,2.24L氯气的物质的量为0.1mol,而氯气与水的反应为可逆反应;
B、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4,则反应后的气体的物质的量小于0,75mol;
N2O4,则反应后的气体的物质的量小于0,75mol;
C、求出混合气体的物质的量,然后根据CO和NO中均含1个氧原子来分析;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、标况下,2.24L氯气的物质的量为0.1mol,而氯气与水的反应为可逆反应,不能进行彻底,故转移的电子的数目小于0.2NA个,故A错误;
B、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4,则反应后的气体的物质的量小于0,75mol,混合后所含分子数目小于0.75NA,故B错误;
N2O4,则反应后的气体的物质的量小于0,75mol,混合后所含分子数目小于0.75NA,故B错误;
C、标况下,22.4L混合气体的物质的量为1mol,而CO和NO中均含1个氧原子,故1mol混合气体中含1mol氧原子,个数为NA个,故C正确;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故将1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目小于NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.化学来自于生活,用于生活,下表是生活中常用物质溶液的PH值及主要成分的化学式:
试回答:
(1)将上表①~⑤中主要成分进行分类(填序号,下同):属于酸的是①;属于碱的是④;属于盐的是⑤;属于有机物的是①②③.
(2)当有人被蚊虫(释放一种酸性物质)叮咬后,为减轻疼痛,可在伤处涂④⑤.
(3)用久的铝壶内有水垢(主要成分为CaCO3、Mg(OH)2可用①少量多次清除.
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 名称 | 食醋 | 白酒 | 白糖水 | 石灰水 | 纯碱溶液 |
| 主要成分 | CH3COOH | C2H5OH | C12H22O11 | Ca(OH)2 | Na2CO3 |
| 溶液PH | 3 | 7 | 7 | 11 | 10 |
(1)将上表①~⑤中主要成分进行分类(填序号,下同):属于酸的是①;属于碱的是④;属于盐的是⑤;属于有机物的是①②③.
(2)当有人被蚊虫(释放一种酸性物质)叮咬后,为减轻疼痛,可在伤处涂④⑤.
(3)用久的铝壶内有水垢(主要成分为CaCO3、Mg(OH)2可用①少量多次清除.
10.下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol•L-1HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1mol•L-1HNO2溶液稀释至100倍,pH约为3.1.
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol•L-1HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1mol•L-1HNO2溶液稀释至100倍,pH约为3.1.
| A. | ①④⑥ | B. | ①②③④ | C. | ①④⑤⑥ | D. | 全部 |
20.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度 为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
回答下列问题:
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)
附表:溶解度表
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度 为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T2/℃ |
| Ha2CO2 | 23.3 | 20.0 | 23.7 |
| HaCO2 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)
附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Ha2CO2 | 12.5g | 21.5g | 39.7g | 40.g |
| HaHCO2 | 8.1g | 9.6g | 11.1g | 12.7 |
3.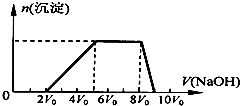 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:
为探究其成分,进行了以下探究实验.
(1)探究一:甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定含有的阳离子是H+、NH4+、Al3+,其对应物质的量浓度之比为2:3:1,一定不存在的阴离子是CO32-、AlO2-;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2$_2^-$+2H2O.
(2)探究二:乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①原溶液中Cl-、Br-、I-的物质的量浓度之比为(最简整数比)10:15:3.
②当通入Cl2的体积达到11.2L时,溶液中发生的总反应的离子方程式可表示为:5Cl2+6I-+4Br-=10Cl-+3I2+2Br2.
 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定含有的阳离子是H+、NH4+、Al3+,其对应物质的量浓度之比为2:3:1,一定不存在的阴离子是CO32-、AlO2-;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2$_2^-$+2H2O.
(2)探究二:乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
②当通入Cl2的体积达到11.2L时,溶液中发生的总反应的离子方程式可表示为:5Cl2+6I-+4Br-=10Cl-+3I2+2Br2.
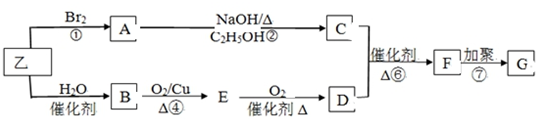
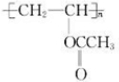 .
. .
.
