题目内容
10.(1)将等质量的Zn粉分别投入:a:10mL 0.1mol•L-1 HCl和b:10mL 0.1mol•L-1醋酸中.①若Zn不足量,则反应速率a>b;(填“>”、“=”或“<”,下同)
②若Zn过量,产生H2的量a=b;
③若Zn不足量,产生H2的量a=b;
(2)将等质量的Zn粉分别投入pH=1,体积均为10mL的a:盐酸和b:醋酸中.
①若Zn不足量,则起始反应速率a=b;
②若Zn过量,产生H2的量a<b;
③若Zn不足量,产生H2的量a=b.
分析 (1)物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,
①若Zn不足量,酸有剩余,相同浓度的醋酸和盐酸中,反应过程中醋酸中氢离子浓度小于盐酸,氢离子浓度越大,反应速率越大;
②若Zn过量,产生H2的量与酸的物质的量成正比;
③若Zn不足量,产生H2的量与锌的物质的量成正比;
(2)pH相等的醋酸和盐酸,醋酸浓度大于盐酸,
①若Zn不足量,酸过量,起始醋酸中氢离子浓度等于盐酸,离子浓度越大,其反应速率越大;
②若Zn过量,产生H2的量与酸的物质的量成正比;
③若Zn不足量,产生H2的量与锌的物质的量成正比.
解答 解:(1)物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,
①若Zn不足量,酸有剩余,相同浓度的醋酸和盐酸中,盐酸中氢离子浓度大于醋酸,所以盐酸反应速率大于醋酸,故答案为:>;
②若Zn过量,产生H2的量与酸的物质的量成正比,醋酸和盐酸都是一元酸,且体积、浓度相等,则其物质的量硝酸,所以生成氢气的物质的量相等,故答案为:=;
③若Zn不足量,产生H2的量与锌的物质的量成正比,等质量的Zn粉反应,所以生成氢气的物质的量相等,故答案为:=;
(2)pH相等的醋酸和盐酸,醋酸浓度大于盐酸,
①若Zn不足量,酸过量,起始醋酸中氢离子浓度等于盐酸,所以起始反应速率醋酸等于盐酸,故答案为:=;
②若Zn过量,酸不足,产生H2的量与酸的物质的量成正比,pH相等、体积相等的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸产生氢气的量大于盐酸,故答案为:<;
③若Zn不足量,产生H2的量与锌的物质的量成正比,等质量的Zn粉反应,所以生成氢气的物质的量相等,故答案为:=;
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道反应速率与离子浓度成正比、与电解质强弱无关,为易错点.

 发散思维新课堂系列答案
发散思维新课堂系列答案| 实 验 | 现 象 | 结论 | |
| A | 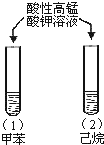 | 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 苯环使甲基的活性增强 |
| B | 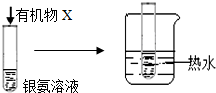 | 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
| D | 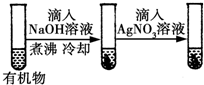 | 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
| A. | A | B. | B | C. | C | D. | D |
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)在一定条件下,A与E可形成化合物的化学式是NH3,其水溶液呈碱性(填“酸”、“碱”或“中”).
(3)写出A与F形成化合物的电子式
 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑. (1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态.
| A. | (1)(4) | B. | (2)(3) | C. | (1)(3)(4) | D. | (1)(2)(3)(4) |
| A. | AlCl3 | B. | Na2SO3 | C. | KMnO4 | D. | MgSO4 |
| A. | 1.2mol | B. | 1.1mol | C. | 1.8 mol | D. | 1.6mol |
| A. | 在元素周期表中,每一列就是一个族 | |
| B. | 主族元素都是短周期元素 | |
| C. | 副族元素都是金属元素 | |
| D. | 元素周期表每个长周期包含32种元素 |
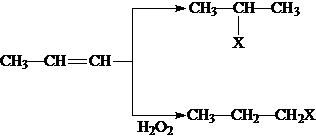 (X为溴原子)
(X为溴原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.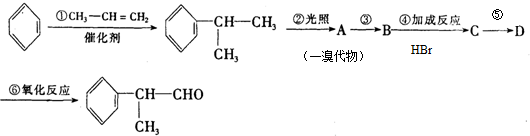
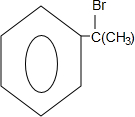
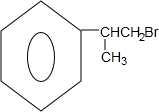 .
. 、
、 、
、 任意1种.
任意1种.