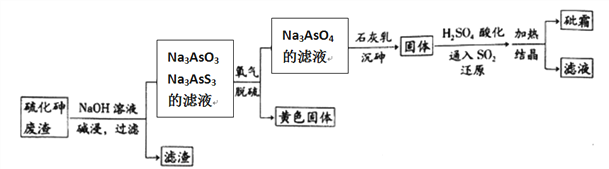
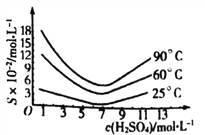
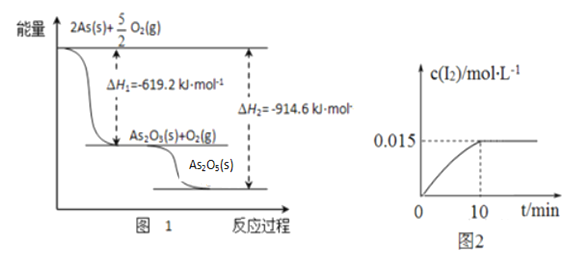
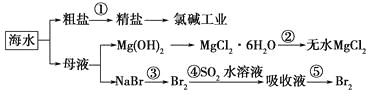
题目内容
【题目】现有镁、铝合金5.1g完全溶于稀盐酸中,在标准状况下共收集到氢气5.6L,计算:
(1)氢气的物质的量是 。
(2)双线桥法表示出铝和盐酸反应的电子转移的方向和数目?
(3)求这种合金中镁、铝的物质的量分别是多少?
【答案】(1)0.25mol;(2)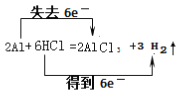 ;(3)Mg、Al的物质的量都是0.1mol
;(3)Mg、Al的物质的量都是0.1mol
【解析】
(1)氢气的物质的量是![]() =0.25mol;(2)铝和盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑,反应中H元素化合价由+1价降低到0价,Al元素化合价由0价升高到+3价,由化合价变化可知,电子转移方向和数目用双线桥法表示为:
=0.25mol;(2)铝和盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑,反应中H元素化合价由+1价降低到0价,Al元素化合价由0价升高到+3价,由化合价变化可知,电子转移方向和数目用双线桥法表示为: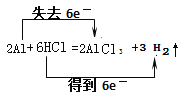 ;(3)设合金中镁、铝的物质的量分别为x、y,根据反应Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,则:
;(3)设合金中镁、铝的物质的量分别为x、y,根据反应Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,则:
24x+27y=5.1g,x+![]() y=0.25mol,联立两式求得x=0.1mol,y=0.1mol。故Mg、Al的物质的量都是0.1mol。
y=0.25mol,联立两式求得x=0.1mol,y=0.1mol。故Mg、Al的物质的量都是0.1mol。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
【题目】下列物质与水反应生成强碱的是( )
A. NH3 B. Na2O C. CO2 D. NO2
【答案】B
【解析】
A. NH3溶于水生成一水合氨,属于弱碱,A错误;B. Na2O溶于水生成氢氧化钠,是强碱,B正确;C. CO2溶于水生成碳酸,属于弱酸,C错误;D. NO2溶于水生成硝酸和NO,硝酸是强酸,D错误,答案选B。
【题型】单选题
【结束】
19
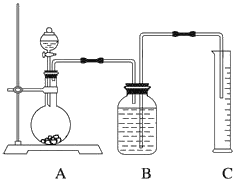
【题目】利用下列装置可以完成的实验组合是

选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D