题目内容
【题目】Ⅰ、为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
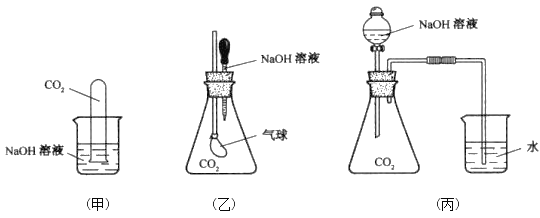
(1)请写出甲实验中CO2与过量的NaOH发生反应的离子方程式:__________。
(2)丙实验装置的实验现象是________________________。
(3)乙实验中,如果二氧化碳和氢氧化物的物质的量之比为1:1.5,且恰好完全反应,溶液中含有的溶质主要是_______________。
A、NaOH 和Na2CO3 B、Na2CO3 C、Na2CO3和NaHCO3 D、NaHCO3
Ⅱ、为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图:
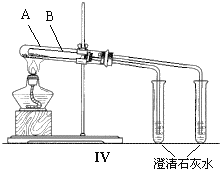
(1)小试管B中应装的药品是________(写化学式)。
(2)和大试管A相连的装有澄清石灰水的小试管中出现的现象预计是____________________。
Ⅲ、工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)称取质量为m1 g的样品溶解后加入过量的CaCl2溶液,将所得沉淀______________(填操作)、洗涤、烘干、称量得到m2 g固体,则Na2CO3的质量分数是_____________________。
方案二:气体分析法
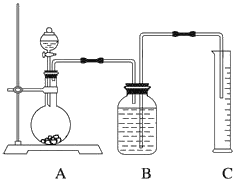
(2)把一定量的样品与足量盐酸反应,用下图所示装置测定产生CO2的体积,实验结束后,量筒中得到V mL液体,则反应中生成二氧化碳的物质的量是____________(题目中气体体积均已经换算成标准状况),为了确保测定结果的准确性,B中的溶液为饱和碳酸氢钠,因为二氧化碳难溶于饱和碳酸氢钠,但选用该溶液后实验结果仍然不够准确,Na2CO3的质量分数偏大,其原因可能是___________。
【答案】CO2+ 2 OH-===CO32-+H2O 烧杯内的水流入锥形瓶中 C NaHCO3 加热时有气泡产生 过滤 53m2/50m1 0.001V/22.4mol或V/22400mol或5V/112000mol或4.46 V× 10-5mol 盐酸易挥发,和B装置中NaHCO3反应,产生二氧化碳气体
【解析】
Ⅰ、(1)二氧化碳与过量的氢氧化钠反应生成碳酸钠和水,故离子方程式写成:CO2+ 2 OH-=CO32-+H2O;(2)丙装置锥形瓶中气体减少,压强减小,烧杯内的的水会倒吸入锥形瓶中;
(3)根据反应方程式CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,如果二氧化碳和氢氧化物的物质的量之比为1:1.5,且恰好完全反应,溶液中含有的溶质主要是Na2CO3和NaHCO3,且物质的量之比为1:1;Ⅱ、(1)套管实验中,碳酸钠放在大试管中直接受热,碳酸氢钠放在小试管中,间接受热,故小试管中装的为NaHCO3;(2)碳酸钠不分解,加热时空气膨胀,导管口有空气排出,故和大试管A相连的装有澄清石灰水的小试管中出现的现象预计是加热时有气泡产生;Ⅲ、(1)碳酸钠与氯化钙反应生成碳酸钙沉淀,所以分离沉淀需要经过过滤操作;设Na2CO3的质量分数是x,则
CaCl2+ Na2CO3= CaCO3↓+ NaCl
106 100
xm1 g m2 g
x=![]() =
=![]() ;
;
(2)把一定量的样品与足量盐酸反应,用下图所示装置测定产生CO2的体积,实验结束后,量筒中得到V mL液体,排出液体的体积就是产生的气体的体积,则反应中生成二氧化碳的物质的量是![]() =
=![]() mol;盐酸易挥发,和B装置中NaHCO3反应产生二氧化碳气体,使实验数据变大,碳酸钠的质量分数偏大。
mol;盐酸易挥发,和B装置中NaHCO3反应产生二氧化碳气体,使实验数据变大,碳酸钠的质量分数偏大。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
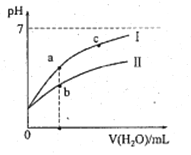
小学期末标准试卷系列答案【题目】下表为25℃时某些弱酸的电离平衡常数;下边图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
弱酸的电离平衡常数(25℃) | |
CH3COOH | HClO |
Ka=1.8×10-5 | Ka=3.0×10-8 |
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH-)+c(CH3COO-)>NaClO溶液的c(OH-)+c(C1O-)

