题目内容
14.完成下列反应的化学方程式、或要求:(1)写出少量氯气和碘化钾溶液反应的化学反应方程式2KI+Cl2=I2+2KCl.
(2)用双线桥标出下述反应中电子转移的方向和数目:C+4HNO3(浓)$\frac{\underline{\;△\;}}{\;}$ CO2↑+4NO2↑+2H2O.
分析 (1)少量氯气和碘化钾溶液生成碘单质和氯化钠;
(2)该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,所以碳作还原剂、硝酸作氧化剂,转移电子数是4.
解答 解:(1)少量氯气和碘化钾溶液反应,反应的化学方程式:2KI+Cl2=I2+2KCl,故答案为:2KI+Cl2=I2+2KCl;
(2)该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,得失电子最小公倍数是4,则转移电子数为4,所以电子转移的方向和数目为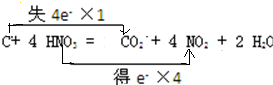 ,
,
故答案为: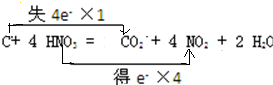 .
.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应离子方程式书写和电子转移标注,明确物质的性质及发生反应实质是解题关键,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
2.有关有机物的燃烧下列说法正确的是( )
| A. | 可用点燃的方法鉴别甲烷,乙烯,丙烯和苯乙烯 | |
| B. | 1体积某气态烃完全燃烧生成的CO2比水蒸气少1体积(在相同条件下测定)可推知该烃为烷烃 | |
| C. | 等质量的乙醛和乙炔的耗氧量相同 | |
| D. | 任意比例混合的乙烯和1,3-丁二烯燃烧时只要总质量一定则生成的产物的质量也为定值 |
9.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
| A. | 增加C的量 | |
| B. | 将容器的体积减小一半 | |
| C. | 保持体积不变,充入氮气使体系的压强增大 | |
| D. | 保持压强不变,充入氮气使体系的体积增大 |
19.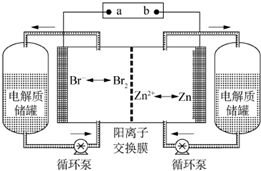 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 充电时,阳离子通过交换膜移向装置右侧 | |
| B. | 充电时,左侧与右侧的溴化锌溶液的浓度差将减小 | |
| C. | 放电时装置发生的总反应为:Zn+Br2═ZnBr2 | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
6.A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构.下列叙述中一定不正确的是( )
| A. | 它们的原子序数A>B>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
3.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1L 1mol/L 盐酸中含有HCl分子数为 1NA | |
| B. | 常温常压下,22.4L氧气所含的原子数为2NA | |
| C. | 实验室分别用KClO3和H2 O2制取3.2g O2时,转移的电子数均为0.4NA | |
| D. | 常温常压下,16 g 由O2和O3组成的混合气体所含电子数为8NA |
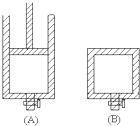 有两个容积相等的密闭容器A和B(如图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变.起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等.在400℃条件下,发生如下反应:2SO2(g)+O2(g)?2SO3(g).
有两个容积相等的密闭容器A和B(如图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变.起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等.在400℃条件下,发生如下反应:2SO2(g)+O2(g)?2SO3(g). ;
;