题目内容
3.在水溶液中能够大量共存的是( )| A. | Na+、C1-、NO3-、Ba2+ | B. | Ag+、C1-、NO3-、Ca2+ | ||
| C. | NH4+、OH-、SO42-、Cu2+ | D. | Na+、Fe2+、OH-、H+ |
分析 A.四种离子之间不发生反应;
B.银离子与氯离子反应生成氯化银沉淀;
C.铵根离子、铜离子都与氢氧根离子反应;
D.亚铁离子、氢离子都与氢氧根离子反应.
解答 解:A.Na+、C1-、NO3-、Ba2+之间不发生反应,在溶液中能够大量共存,故A正确;
B.Ag+、C1-之间反应生成难溶物氯化银,在溶液中不能大量共存,故B错误;
C.NH4+、Cu2+都与OH-发生反应,在溶液中不能大量共存,故C错误;
D.Fe2+、H+都与OH-反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
13.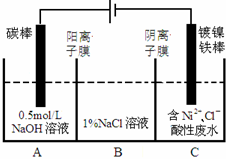 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )
 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )
| A. | 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O | |
| B. | 为了提高Ni的产率,电解过程中需要控制废水pH | |
| C. | 电解过程中,B中NaCl溶液的物质的量浓度将不断减小 | |
| D. | 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
11.下列说法正确的是( )
| A. | 某有机物的结构简式为: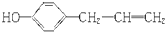 ,按官能团分,既可属于醇类,也可属于烯烃类 ,按官能团分,既可属于醇类,也可属于烯烃类 | |
| B. |  的名称为2-甲基-3-丁烯 的名称为2-甲基-3-丁烯 | |
| C. | 用分液的方法分离乙酸和乙酸乙酯 | |
| D. | 用重结晶的方法提纯苯甲酸 |
18.只能用排水集气法的气体是( )
| A. | NH3 | B. | Cl2 | C. | HCl | D. | NO |
8.下列化合物中,不能由单质直接化合而得到的是( )
| A. | SiO2 | B. | HCl | C. | FeCl2 | D. | NO |
15.下列反应即属于氧化还原反应又属于置换反应的是( )
| A. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | B. | 3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | ||
| C. | 2Mg+CO2═C+2MgO | D. | CO+H2O(g)═CO2+H2 |
14.H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示:下列说法正确的是( )
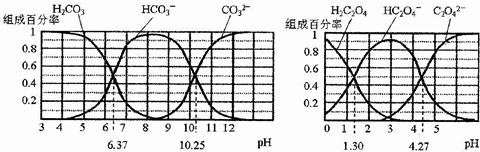

| A. | 在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
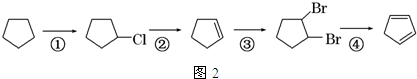
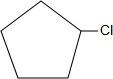 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$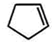 +NaCl+H2O;反应的化学方程式:
+NaCl+H2O;反应的化学方程式: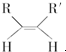 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式:
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式: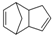 $\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$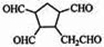 ;
;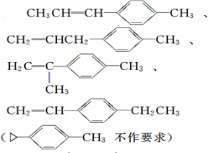 .
.