题目内容
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是________(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1mol/L氨水pH为11
C.铵盐受热易分解
D.常温下,0 1mol/L氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是______(填学母序号)。
A.通入氨气 B.如入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)25℃,在0.1mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,密液pH与c(S2-
关系如下图(忽略溶液体积的变化、H2S的挥发)。
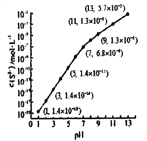
①pH=13 时,溶液中的c(H2S)+c(HS-)=______mol/L。
②某溶液含0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=____时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)聚合硫酸铁(PFS) 是水处理中重要的絮凝剂。盐基度B是衡量絮凝剂紫凝效果的重要指标,定义式为B=3n(OH-)/n(Fg3+)(n为物质的量)。为测量样品的B值。取样品mg,准确加入过量盐酸,充分反应,再加入点沸后冷却的蒸馏水,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液VmL。按照上述步骤做空白对照试验,消耗NaOH溶液V0mL已知该样品中Fe的质量分数w,则B 的表达式为_________。
(4)常温时,若Ca(OH)2和CaWO4 (钨酸钙) 的沉淀溶解平衡曲线如图所示(已知: ![]() =0.58)。
=0.58)。
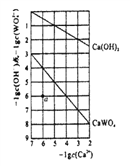
①a点表示Ca(OH)2和CaWO4________(填“是”或“否”)达到溶解平衡,说 明理由_______________。
②饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合,写出混合溶液中各离了浓度大小关系__________。
【答案】 BD BC 0.043 5 ![]() 否 Kap[Ca(OH)2]=c(Ca2+)·c2(OH-)=10-7,Ksp(CaMO4)=c(Ca2+)·c(MO42-)=10-10,a点的浓度商Q[Ca(OH)2]=10-6小于Ksp[Ca(OH)2],Q(CaWO4)=10-12小于Ksp(CaMO4),所以a点表示的Ca(OH)2与CaMO4均未达到溶解平衡。 c(OH-)>c(Ca2+)>c(MO42-)>c(H+)
否 Kap[Ca(OH)2]=c(Ca2+)·c2(OH-)=10-7,Ksp(CaMO4)=c(Ca2+)·c(MO42-)=10-10,a点的浓度商Q[Ca(OH)2]=10-6小于Ksp[Ca(OH)2],Q(CaWO4)=10-12小于Ksp(CaMO4),所以a点表示的Ca(OH)2与CaMO4均未达到溶解平衡。 c(OH-)>c(Ca2+)>c(MO42-)>c(H+)
【解析】(1)①A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁,该反应为复分解反应,无论是强碱还是弱碱均有该反应,不能说明氨水是弱碱,选项A错误;B.常温下,0. 1 mol·L-1氨水pH为11,说明氨水不能完全电离,如果完全电离溶液的pH应为13,能说明氨水是弱碱,选项B正确;C.铵盐不稳定受热易分解,与氨水是弱碱无任何关联,选项C错误; D.常温下,0. 1mol·L-1氯化铵溶液的pH为5 ,说明NH4+能水解,可知氨水是弱碱,选项D正确,答案为BD;②A.通入氨气促进电离,但氨水的电离度减小,选项A不正确;B.加入少量氯化铁固体,因生成氢氧化铁沉淀,促进氨水电离,电离度增大,选项B正确;C.加水稀释,促进氨水电离,电离度增大,选项C正确; D.加入少量氯化铵固体,抑制氨水电离,电离度减小,选项D错误,答案为BC;(2) ①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10molL-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,可知c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L;②当Qc=Ksp(MnS)时开始沉淀,所以![]() ,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀;(3)做空白对照试验,消耗NaOH溶液,这说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是
,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀;(3)做空白对照试验,消耗NaOH溶液,这说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是![]() ,因此B的表达式为
,因此B的表达式为![]() ;(4)①a点表示Ca(OH)2和CaWO4没有达到溶解平衡,Kap[Ca(OH)2]=c(Ca2+)·c2(OH-)=10-7,Ksp(CaMO4)=c(Ca2+)·c(MO42-)=10-10,a点的浓度商Q[Ca(OH)2]=10-6小于Ksp[Ca(OH)2],Q(CaWO4)=10-12小于Ksp(CaMO4),所以a点表示的Ca(OH)2与CaMO4均未达到溶解平衡;②饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合,由图中数据可得,当
;(4)①a点表示Ca(OH)2和CaWO4没有达到溶解平衡,Kap[Ca(OH)2]=c(Ca2+)·c2(OH-)=10-7,Ksp(CaMO4)=c(Ca2+)·c(MO42-)=10-10,a点的浓度商Q[Ca(OH)2]=10-6小于Ksp[Ca(OH)2],Q(CaWO4)=10-12小于Ksp(CaMO4),所以a点表示的Ca(OH)2与CaMO4均未达到溶解平衡;②饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合,由图中数据可得,当![]() ,
, ![]() ,此时,
,此时, ![]() ,
, ![]() ,
, ![]() ,
,![]() ,
, ![]() ,故混合溶液中各离了浓度大小关系c(OH-)>c(Ca2+)>c(MO42-)>c(H+)。
,故混合溶液中各离了浓度大小关系c(OH-)>c(Ca2+)>c(MO42-)>c(H+)。