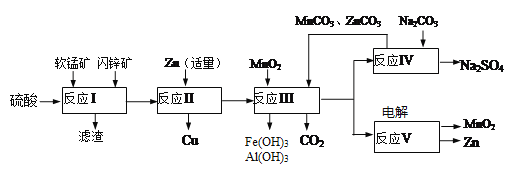
题目内容
【题目】向20mL0.5mol/L的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
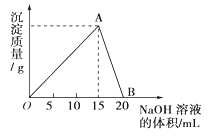
(1)写出AB段发生反应的离子方程式___________。
(2)A点表示的意义是__________。
(3)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_______mL或______mL。
【答案】Al(OH)3+OH-=AlO2-+2H2O AlCl3和NaOH溶液恰好完全反应,沉淀量达到最大值 7.5mL 17.5mL
【解析】
向20mL0.5mol/L的AlCl3溶液中逐滴滴加2 mol/L NaOH溶液时,过程中发生的反应先后为①Al3++3OH-=Al(OH)3↓、②Al(OH)3+OH-=AlO2-+2H2O,图象中OA段为发生反应①,AB段为氢氧化铝溶解发生反应②,依据各步反应分析判断,进行有关计算。
(1)开始AlCl3与NaOH反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量;随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失,所以AB段发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(2)根据(1)中分析可知A点表示的意义是AlCl3和NaOH溶液恰好完全反应,沉淀量达到最大值;
(3)20mL0.5mol/L的AlCl3溶液中氯化铝的物质的量是0.02L×0.5mol/L=0.01mol,所得沉淀量为0.39g,即生成的氢氧化铝是0.39g÷78g/mol=0.005mol。则如果反应中氢氧化钠不足,氯化铝过量,根据AlCl3+3NaOH=Al(OH)3↓+3NaCl可知消耗氢氧化钠是0.005mol×3=0.015mol,所需氢氧化钠溶液的体积为0.015mol÷2mol/L=0.0075L=7.5mL;如果反应中氯化铝完全转化为氢氧化铝,然后氢氧化铝又部分溶解,根据AlCl3+3NaOH=Al(OH)3↓+3NaCl可知消耗氢氧化钠是0.01mol×3=0.03mol,生成0.01mol氢氧化铝后又溶解0.005mol,根据Al(OH)3+OH-=AlO2-+2H2O可知消耗氢氧化钠是0.005mol,因此总共消耗氢氧化钠是0.03mol+0.005mol=0.035mol,所需氢氧化钠溶液的体积是0.035mol÷2mol/L=0.0175L=17.5mL。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为__________________,As基态原子核外有____个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是___________,Ga、As、Se的电负性由大到小的顺序是_________________。
(3)比较下列镓的卤化物的熔点和佛点,分析其变化规律及原因:_________________。
镓的卤化物 | GaI3 | GaBr3 | GaCl3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是______________。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为___________,草酸根中碳原子的杂化轨道类型为______________。

(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为_____g/cm3(设NA为阿伏加德罗常数的值,列出计算式即可)。