题目内容
【题目】重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等。其水溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+
+2H+
(1)已知有关物质溶解度如图1。用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入_________(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时,_____________,抽滤得到粗产品,再用重结晶法提纯粗产品。
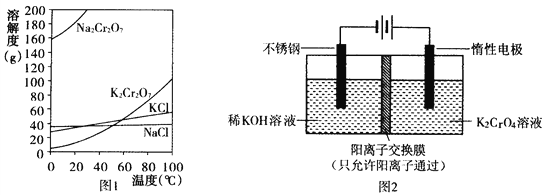
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2。
①不锈钢作________极,写出该电极的电极反应式________________________。
②分析阳极区能得到重铬酸钾溶液的原因________________________。
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为____________。
(3)铬对环境能造成污染。某酸性废水中含有![]() ,处理时可用焦亚硫酸钠(Na2S2O5)将
,处理时可用焦亚硫酸钠(Na2S2O5)将![]() 转化为毒性较低的Cr3+,再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mg·L-1则达到排放标准。
转化为毒性较低的Cr3+,再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mg·L-1则达到排放标准。
①Na2S2O5参加反应的离子方程式为____________________。
②经上述工艺处理后的废水,理论上Cr3+浓度约为__________mg·L-1。(已知室温下Ksp≈6×10-31)
【答案】 KCl 冷却结晶 阴 2H2O+2e—=2OH—+H2↑ 阳极OH—放电,溶液中H+浓度增大,使Cr2O72-+ H2O![]() 2 CrO42-+ 2H+向生成Cr2O72-方向移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7 2-x 3S2O52—+2Cr2O72-+10H+=6SO42—+4Cr3++5H2O 3×10-8
2 CrO42-+ 2H+向生成Cr2O72-方向移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7 2-x 3S2O52—+2Cr2O72-+10H+=6SO42—+4Cr3++5H2O 3×10-8
【解析】试题分析:(1)Na2Cr2O7与KCl发生复分解反应,所以化学方程式为:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl;根据图像可知:低温下K2Cr2O7溶解度远小于其它组分,随温度的降低,K2Cr2O7溶解度明显减小。所以向Na2Cr2O7溶液中加入KCl,搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时,冷却结晶,抽滤得到粗产品,再用重结晶法提纯粗产品;(2)①不锈钢与电源的负极相连,故为阴极,阴极上氢离子得电子生成氢气,电极方程式为2H2O+2e—=2OH—+H2↑;②惰性电极上氢氧根离子失电子生成氧气,其电极方程式为:2H2O-4e-═4H++O2↑,阳极区酸性增强,使Cr2O72-+ H2O![]() 2 CrO42-+ 2H+向生成Cr2O72-方向移动,部分K+通过阳离子交换膜移动到阴极区,所以阳极区能得到重铬酸钾溶液;③设开始时K2CrO4的物质的量是a mol, 2 K2CrO4 K2Cr2O7
2 CrO42-+ 2H+向生成Cr2O72-方向移动,部分K+通过阳离子交换膜移动到阴极区,所以阳极区能得到重铬酸钾溶液;③设开始时K2CrO4的物质的量是a mol, 2 K2CrO4 K2Cr2O7
起始量(mol) a 0
转化量(mol) a x![]() x
x
平衡量(mol) a-ax![]() x
x
阳极区的钾离子:2×a-ax)+2×![]() x ,铬:a
x ,铬:a
由题目已知,可得:K/Cr="(2a-ax)/a=" 2-x
(3)①焦亚硫酸钠(Na2S2O5)将![]() 还原为毒性较低的Cr3+,反应的离子方程式为3S2O52—+2Cr2O72-+10H+=6SO42—+4Cr3++5H2O;②调节pH约为8,
还原为毒性较低的Cr3+,反应的离子方程式为3S2O52—+2Cr2O72-+10H+=6SO42—+4Cr3++5H2O;②调节pH约为8,![]() ,Ksp[Cr(OH)3]≈6×10-31,即
,Ksp[Cr(OH)3]≈6×10-31,即![]() ≈6×10-31,
≈6×10-31,![]() =6×10-13
=6×10-13![]() ,约合3×10-8mg·L-1。
,约合3×10-8mg·L-1。

【题目】下列除杂试剂或方法不正确的是( )
选项 | 被提纯物质 | 杂质 | 除杂试剂或方法 |
A | FeCl3溶液 | FeCl2 | 通入适量Cl2 |
B | FeCl2溶液 | FeCl3 | 加入过量铁粉并过滤 |
C | 铁粉 | 铝粉 | 加入过量NaOH溶液并过滤 |
D | Fe(OH)3 | Fe(OH)2 | 在空气中灼烧 |
A. A B. B C. C D. D
