题目内容
[化学一选修3:物质结构与性质](15分)
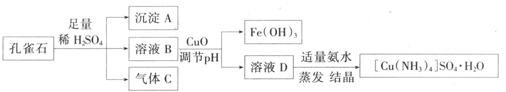
一水硫酸四氨合铜(II)(化学式为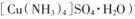 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
请回答:
(1) 沉淀A的晶体中最小环上的原子个数为______,气体C分子中 键和
键和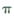 键的个数比为______
键的个数比为______
(2) 溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______
(3) MgO的熔点高于CuO的原因为____________
(4) 画出一水硫酸四氨合铜(II)中配离子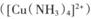 的配位键____________。
的配位键____________。
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。
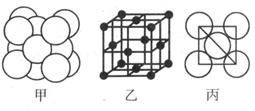
①铜单质晶体中原子的堆积方式为____________,晶胞中Cu原子的配位数为______
②若Cu原子半径为acm,则Cu单质晶体的密度为______g/cm3(只列出计算式,阿伏加德罗常数的值为NA)。
一水硫酸四氨合铜(II)(化学式为
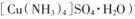 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
请回答:
(1) 沉淀A的晶体中最小环上的原子个数为______,气体C分子中
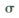 键和
键和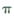 键的个数比为______
键的个数比为______(2) 溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______
(3) MgO的熔点高于CuO的原因为____________
(4) 画出一水硫酸四氨合铜(II)中配离子
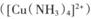 的配位键____________。
的配位键____________。(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。

①铜单质晶体中原子的堆积方式为____________,晶胞中Cu原子的配位数为______
②若Cu原子半径为acm,则Cu单质晶体的密度为______g/cm3(只列出计算式,阿伏加德罗常数的值为NA)。
(1)12 (2分) 1:1 (2分) (2)正四面体(1分) sp3 (1分)
(3)MgO的晶格能大(2分,其他合理答案也可给分)(4)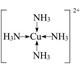 (2分)
(2分)
(5)①面心立方最密堆积(1分)②12 (1分)③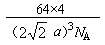 (3分,其他合理答案也给分)
(3分,其他合理答案也给分)
(3)MgO的晶格能大(2分,其他合理答案也可给分)(4)
 (2分)
(2分)(5)①面心立方最密堆积(1分)②12 (1分)③
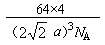 (3分,其他合理答案也给分)
(3分,其他合理答案也给分)(1)孔雀石中的二氧化硅和硫酸不反应,所以沉淀A是二氧化硅。二氧化硅是原子晶体,晶体中最小环上的原子个数为12个。C是CO2气体,分子中含有碳氧双键。由于双键是由1个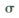 键和1和
键和1和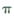 键构成的,是由二者的个数之比是1︰1的。
键构成的,是由二者的个数之比是1︰1的。
(2)溶液中D是硫酸铜,阴离子是SO42-,中心已知硫原子含有的孤对电子是(6+2-2×4)÷2=0,即没有孤对电子,所以是正四面体结构,采用sp3杂化。
(3)氧化镁和氧化铜形成的晶体都是离子晶体,镁离子半径小于铜离子的,所以氧化镁中MgO的晶格能大,熔点高。
(4)一水硫酸四氨合铜中配体是氨气,提高孤对电子,铜提供空轨道,所以结构式是(见答案)。
(5)①铜是面心立方最密堆积。根据甲图可知,和铜原子距离最近的原子共有3×8÷2=12个,所以配位数是12。
②根据乙图可知,一个晶胞中铜原子的数目为8×1/8+6×1/2=4。根据丙图可知,晶胞的边长是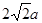 ,所以有
,所以有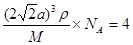 ,解得ρ=
,解得ρ=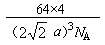 。
。
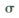 键和1和
键和1和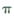 键构成的,是由二者的个数之比是1︰1的。
键构成的,是由二者的个数之比是1︰1的。(2)溶液中D是硫酸铜,阴离子是SO42-,中心已知硫原子含有的孤对电子是(6+2-2×4)÷2=0,即没有孤对电子,所以是正四面体结构,采用sp3杂化。
(3)氧化镁和氧化铜形成的晶体都是离子晶体,镁离子半径小于铜离子的,所以氧化镁中MgO的晶格能大,熔点高。
(4)一水硫酸四氨合铜中配体是氨气,提高孤对电子,铜提供空轨道,所以结构式是(见答案)。
(5)①铜是面心立方最密堆积。根据甲图可知,和铜原子距离最近的原子共有3×8÷2=12个,所以配位数是12。
②根据乙图可知,一个晶胞中铜原子的数目为8×1/8+6×1/2=4。根据丙图可知,晶胞的边长是
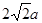 ,所以有
,所以有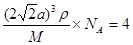 ,解得ρ=
,解得ρ=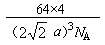 。
。
练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目