题目内容
(10分)(1)(6分)向盛有硫酸铜水溶液的试管里逐渐滴加氨水至过量,观察到的实验现象是: 其反应的离子方程式为: .
(2)(4分)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为 和 。其中心原子的杂化方式分别是 和
(2)(4分)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为 和 。其中心原子的杂化方式分别是 和
(1)(6分)形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。(2分) Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O(2分)
(2)(4分)平面三角形 三角锥形 sp2 sp3 (各1分)
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O(2分)
(2)(4分)平面三角形 三角锥形 sp2 sp3 (各1分)
(1)硫酸铜和氨水反应生成蓝色的氢氧化铜沉淀,但氨水过量时,氢氧化铜能溶解在氨水中形成配合物,是由现象是形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O。
(2)CO32-和SO32-的中心原子含有的孤对电子分别是(4+2-2×3)÷2=0、(6+2-2×3)÷2=1,是由前者是平面三角形,后者三角锥形。因此中心原子的杂化类型分别是sp2杂化和sp3杂化。
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O。
(2)CO32-和SO32-的中心原子含有的孤对电子分别是(4+2-2×3)÷2=0、(6+2-2×3)÷2=1,是由前者是平面三角形,后者三角锥形。因此中心原子的杂化类型分别是sp2杂化和sp3杂化。

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
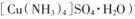 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下: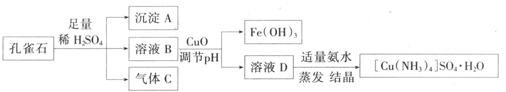
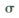 键和
键和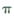 键的个数比为______
键的个数比为______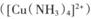 的配位键____________。
的配位键____________。