题目内容
12. 元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系. (1)第二周期元素碳、氮、氧的电负性从大到小顺序为O>N>C(用元素符号表示).
(2)第四周期元素砷、硒、溴的第一电离能从大到小顺序为Br>As>Se
(用元素符号表示).
(3)第 IIIA族元素原子具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.
①[B(OH)4]-中B的原子杂化类型为sp3;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为
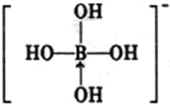 .
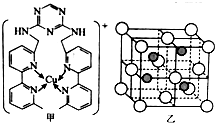
.(4)过渡区元素铜的离子是人体内多种酶的辅因子.某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子:
①写出Cu(Ⅰ)的电子排布式1s22s22p63s23p63d10;
②该离子中含有化学键的类型有ACD(选填字母).
A.极性键 B.离子键 C.非极性键 D.配位键
③向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的晶胞结构如图乙所示.写出该反应的离子方程式2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
分析 (1)同周期从左向右电负性逐渐增大;
(2)同周期从左向右第一电离能增大,但As原子p轨道半满,为稳定结构,则第一电离能比Se的大;
(3)①[B(OH)4]-中B原子形成3个σ键,1个配位键,共含有4个价层电子对,所以采用sp3杂化;
②根据B最外层只有3个电子,只能形成三对共用电子对,所以其中必有一对为配位键;
(4)①根据能量最低原理和洪特规则书写电子排布式;
②同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对的原子和含有空轨道的原子间存在配位键;
③利用均摊法确定M的化学式,铜离子和二氧化硫能发生氧化还原反应生成亚铜离子和硫酸根离子.
解答 解:(1)同周期从左向右电负性逐渐增大,所以碳、氮、氧的电负性从大到小顺序为O>N>C,故答案为:O>N>C;
(2)同周期从左向右第一电离能增大,但As原子p轨道半满,为稳定结构,则第一电离能比Se的大,所以第一电离能为Br>As>Se,故答案为:Br>As>Se;
(3)①[B(OH)4]-中B原子形成3个θ键,1个配位键,共含有4个价层电子对,所以采用sp3杂化,故答案为:sp3;
②因为B最外层只有3个电子,只能形成三对共用电子对,所以[B(OH)4]-结构中必有一对为配位键,则[B(OH)4]-的结构可用示意图表示为 ;故答案为:
;故答案为: ;
;
(4)①Cu的电子排布式为1s22s22p63s23p63d104s1,失去一个电子后生成Cu+,其电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
②该离子中,氮原子和氮原子之间、碳原子和碳原子之间都存在非极性键,碳原子和氮原子之间、氮原子和氢原子之间、碳原子和氢原子之间都存在极性键,铜原子和氮原子间存在配位键;
故答案为:ACD;
③根据晶胞结构知,白色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色小球个数=4,所以该化合物的化学式为:CuCl,二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+;
点评 本题考查晶体结构、杂化轨道、空间构型等,难度中等,主要考查学生阅读对题目信息与结构图获取知识的能力.

| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 在铜的精炼装置中,通常用粗铜作作阴极,精铜作阳极 | |
| C. | 氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
| A. | 5Cl2+I2+6H2O═10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | HCl+NaOH═NaCl+H2O |
| 选项 | 物质 | 杂质 | 所用试剂 | 操作方法 |
| ① | 乙烯 | 二氧化硫 | KMnO4溶液 | 洗气 |
| ② | 乙炔 | 硫化氢 | 氢氧化钠溶液 | 洗气 |
| ③ | 苯 | 甲苯 | 溴水 | 分液 |
| ④ | 溴苯 | 液溴 | 氢氧化钠溶液 | 分液 |
| A. | ②③ | B. | ①④ | C. | ②④ | D. | ①③ |
| A. | 塑料 | B. | Fe | C. | Al | D. | Mg |
| A. | 二氧化碳与苯酚钠溶液 | B. | 乙酸钠溶液与盐酸溶液 | ||
| C. | 苯酚溶液与氯化铁溶液 | D. | 氢氧化铜悬浊液与乙酸溶液 |
 ,
,
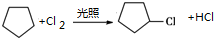 ;(方程式中物质可用键线式表示,下同)
;(方程式中物质可用键线式表示,下同) ;
;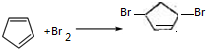 .
.