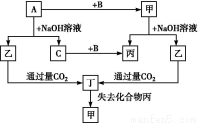
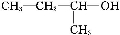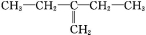题目内容
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
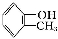
如①CH2=CH2、②HC≡CH、③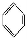 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
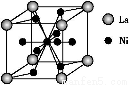
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。该合金的化学式为 ;
(1)3d84s2
(2)N2 CN-(或 )
)
(3)①③④ 平面三角 (4)> (5)LaNi5或Ni5La
【解析】(1)根据构造原理可知,基态Ni原子的价电子(外围电子)排布式为3d84s2。
(2)价电子数与原子数都分别相等的粒子是等电子体,因此与CO互为等电子体的一种分子和一种离子的化学式分别是N2和CN-或 。
。
(3)乙烯、苯、甲醛都是平面形结构,因此碳原子都是sp2杂化。乙炔是直线形结构,所以碳原子是sp杂化,因此答案选①③④。甲醛分子中中心碳原子价层电子对数= =3,且没有弧对电子,因此甲醛是平面三角形结构。
=3,且没有弧对电子,因此甲醛是平面三角形结构。
(4)NiO和FeO形成的晶体都是离子晶体,构成离子晶体的离子半径越小,电荷数越多,离子键越强,晶格能越大,熔点就越高,所以NiO的熔点大于FeO的熔点。
(5)根据晶胞的结构可知,La原子的个数是8×1/8=1,Ni原子个数是8×1/2+1=5,所以化学式是LaNi5或Ni5La。