题目内容
【题目】下列叙述正确的是( ) 
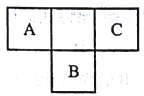
A.如图 1 所示,若铜中含有杂质银,可形成原电池,且铜作负极
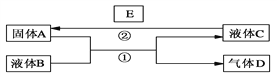
B.如图 2 所示,当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成
C.基于绿色化学理念设计的制取 Cu2O 的电解池如图 2 所示,铜电极发生还原反应
D.若图 3 所示的装置中发生 Cu+2Fe3+═Cu2++2Fe2+的反应,则 X 极是负极,Y 极的材料可 以是铜
【答案】A
【解析】解:A.如图 1 所示,若铜中含有杂质银,则铜能还原三价铁离子,所以能构成原电池,并且活泼铜作负极,故A正确;
B.电极方程式为2Cu﹣2e﹣+2OH﹣=Cu2O+H2O,当有0.1mol电子转移时,有0.05mol Cu2O生成,故B错误;
C.Cu被氧化生成Cu2O,应为电解池的阳极反应,发生氧化反应,故C错误;
D.若图3 所示的装置中发生 Cu+2Fe3+═Cu2++2Fe2+的反应,则Cu为负极即X极是负极,Y极为正极,应为不如铜活泼的金属或者非金属,所以Y极的材料不可以是铜,故D错误.
故选A.

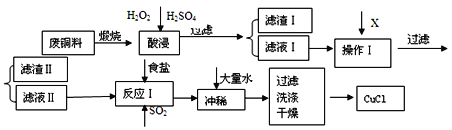
【题目】CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 5.6 | 6.7 |
Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是:______________________________________。
(2)操作Ⅰ为调节溶液的pH值,范围为___________,加入的物质X可以是_________________________ 。
A.CuO B.Cu(OH)2 C .NaOH 溶液 D.CaCO3
(3)滤渣I的主要成分是________,滤渣Ⅱ的主要成分是_________。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl-,写出反应的离子方程式________________________________________________________________________________________ 。
(5)在反应Ⅰ中,加热并使用浓NaC1溶液,主要目的是_____________________________________________________________________________________ 。
【题目】下列实验操作正确且能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 配制FeCl3溶液 | 将FeCl3固体溶解于适量蒸馏水 |
B | 称取2.0gNaOH 固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g 砝码,左盘上添加NaOH 固体 |
C | 检验溶液中是否含有NH4+ | 取少最试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
A. A B. B C. C D. D